在目前诸多LNP疫苗的研发设计过程中,传统上采用注射的方式将RNA等内容物运输至体内。而在实际应用中,口服药物的便捷使得其更受到患者及医生的青睐。此外,包括DC在内的免疫细胞分布于胃肠道黏膜,是体内免疫细胞浓度最高的区域,可以有效接受mRNA-LNP疫苗并引起强免疫应答,从而治疗胃肠道肿瘤。因此,口服LNP疫苗具有良好的胃肠肿瘤应用前景。
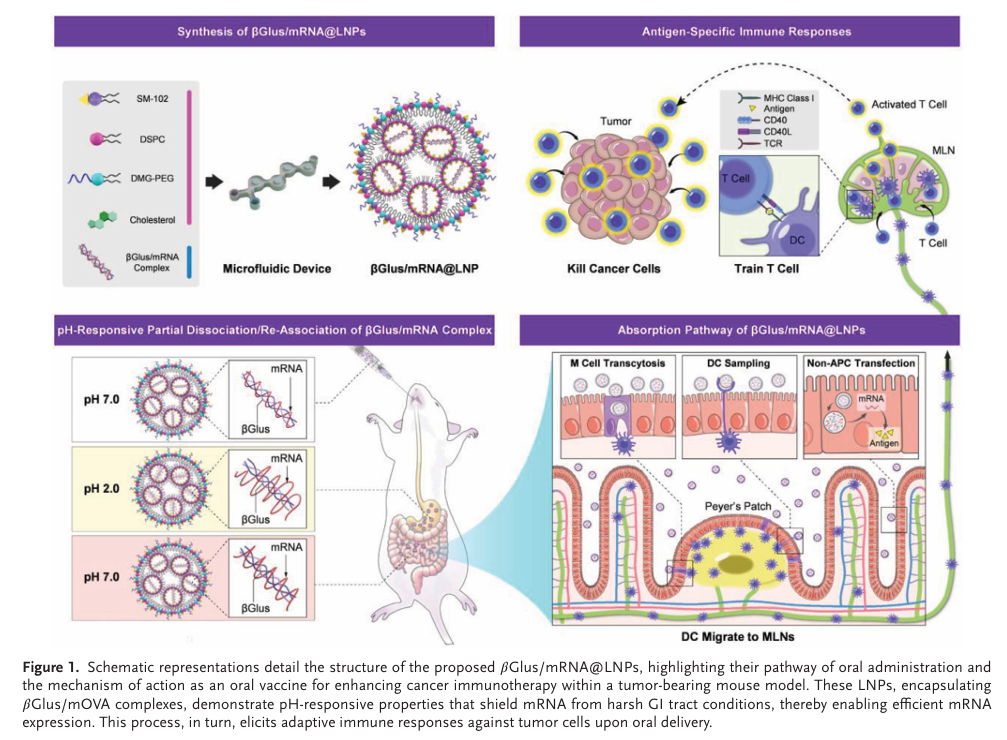
来自我国台湾清华大学的宋信文教授在Advanced Material上发表了题《pH-Responsive β-Glucans-Complexed mRNA in LNPs as an Oral Vaccine for Enhanced Cancer Immunotherapy》的文章。该工作使用β-葡聚糖(βGlus)作为佐剂与保护剂,与mRNA形成复合物,提高其在胃肠道的低pH环境下的稳定性,并促进免疫应答,为开发口服mRNA@LNP疫苗的可行性提供了有力的证据。
1.βGlus/mOVA@LNP的结构与体外性质
结论:βGlus/mOVA@LNP具有适应胃肠道低pH环境的稳定性、良好的被摄取率与强的免疫激活作用。
作者选择鸡卵清白蛋白mRNA(mOVA)进行实验。首先模拟了消化道内酸碱变化过程,验证对mOVA的影响。
据圆二色谱(CD)分析,中性条件下mOVA与βGlus复合物的形成(Fig. 2A,B)。而在酸性条件下βGlus与mOVA释放,形成聚集沉淀使得溶液中mOVA的量减少(Fig. 2A、B)。
将βGlus/mOVA@LNP与mOVA@LNP分别储存14天、模拟胃液(SGF,pH=2.0,含胃蛋白酶)处理、或SGF+模拟肠液(SIF,pH=7.0,含脂肪酶)共处理后拍摄电镜,其形态并没有明显变化(Fig. 2C)。随后分别使用DiO与AF633标记的LNP与βGlus,转染分离的骨髓DC细胞(BMDC),发现LNP能够包裹βGlus并被DC细胞有效摄取,且DiO与AF633共定位(Fig. 2D)。这是𝛽Glus/mOVA稳定结合并被封装在LNP内的强有力证据。使用DiD标记的LNP转染BMDC的实验结果可知,DC细胞对LNP的摄取量随时间增加而增加,并在24h后达到最大值(Fig. 2E)。
对于稳定性的检测发现:将刚合成、与4℃储存14天的mOVA@LNP与βGlus/mOVA@LNP分别进行酸性条件(pH=2.0),以及先酸性后中性处理,进行CD检测。检测结果证实, LNP能够起到保护mRNA的作用,使mRNA能够耐受酸性环境,且能够在短期内稳定储存(Fig. 2F,G)。
对于转染能力的检测发现:βGlus/mEGFP@LNP在未经SGF处理的情况下转染能力受到影响,转染效率显著低于mEGFP@LNP;而经过SGF处理的βGlus/mEGFP@LNP的转染效率与mEGFP@LNP持平;经过SGF与SIF共处理的βGlus/mEGFP@LNP的转染效率显著高于mEGFP@LNP(Fig. 2H)。
DC细胞激活后,CD40会高表达。对于免疫刺激方面的检测发现:游离的mOVA不能提高BMCD表面CD40的表达量,游离的βGlus可以有效地上调CD40的表达。这是因为βGlus可以被免疫细胞的模式识别受体所识别从而激活免疫反应,提高疫苗的治疗效果。而mOVA@LNP与βGlus/mOVA@LNP都能够显著地上调CD40的表达,且βGlus除了作为佐剂提高了疫苗的治疗效果,还可能保护LNP中包裹的mRNA(Fig. 2I)。此外,βGlus/mOVA@LNP还能够上调IL-6与TNF-α的表达,证明βGlus/mOVA@LNP具有优异的免疫激活作用(Fig. 2J,K)。
2.口服给药的体内分布
结论:口服LNP-核酸药物能够有效抵达肠道远端并避免在肝脏中积累。
小鼠口服使用吲哚菁绿标记的LNP后进行近红外荧光成像,发现LNP从胃经过60min可以抵达肠道中端至远端(Fig. 3A)。而且相较于静脉注射的mOVA@LNP,口服的βGlus/mOVA@LNP主要积累于胃肠道中,而不是堆积于肝脏中(Fig. 3B),说明口服LNP疫苗可以避免其肝靶向的劣势。
3.体内DC细胞对LNP的摄取及后续迁移
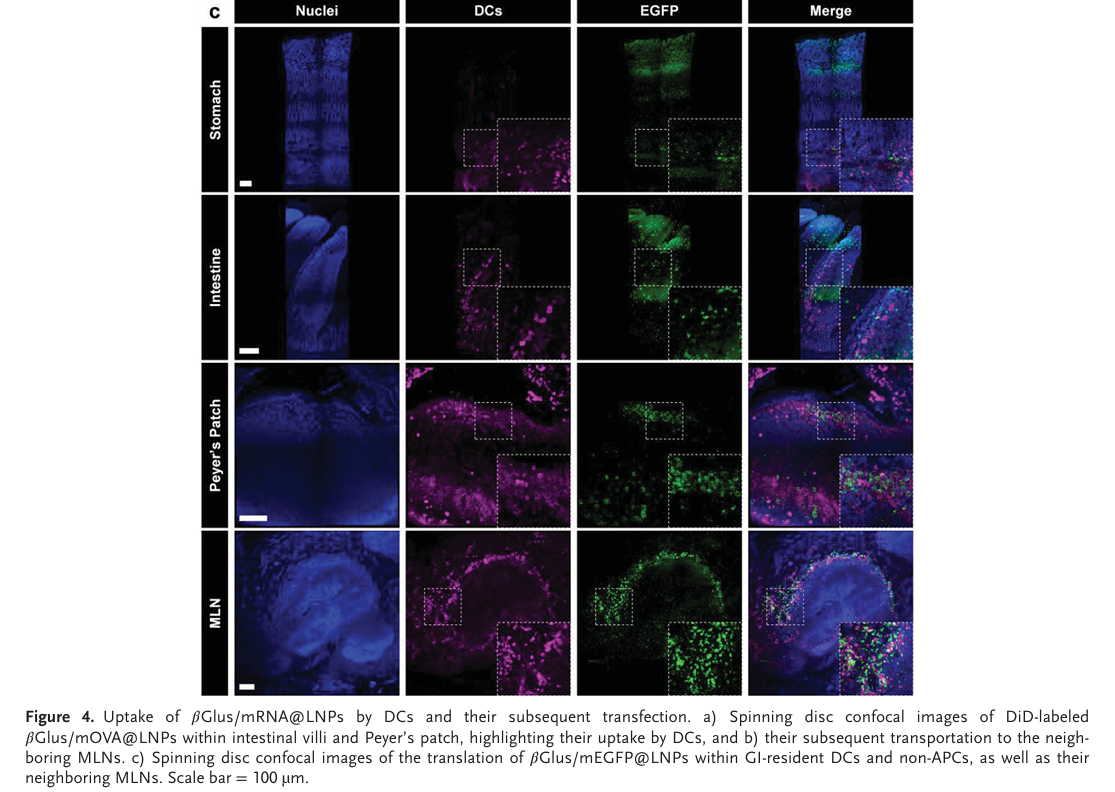
结论:βGlus/mRNA@LNP可以在胃肠道环境中被DC细胞有效摄取并保持翻译活性。
对DiD标记的βGlus/mOVA@LNP与Brilliant violet 421标记的CD11c进行荧光共定位,在小肠、Peyer patch与肠系膜淋巴结中,均能观察到摄取了LNP的DC细胞,同时小肠上皮细胞的非抗原呈递细胞中也能观察到LNP(Fig. 4A,B),证明口服LNP能够广泛地递送mRNA至肠系淋巴细胞及内皮细胞。为了验证mRNA的活性,在小鼠口服βGlus/mEGFP@LNP后进行免疫荧光成像,结果显示在非抗原呈递细胞、DC细胞与肠系膜淋巴结中都能够观察到绿色荧光,说明了βGlus与mRNA的复合物在复杂的胃肠道环境中仍保留了稳定的翻译活性(Fig. 4C)。 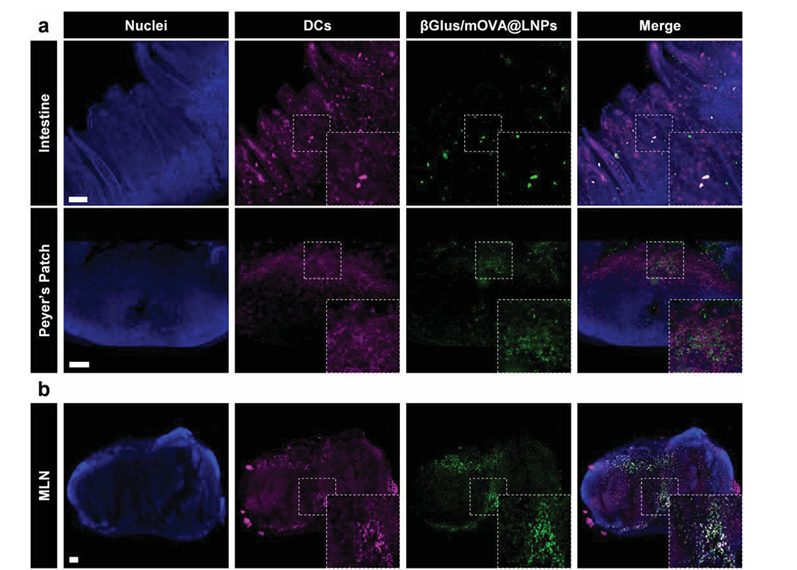
4.静脉注射与口服药物引起的免疫反应对比
结论:βGlus作为佐剂可以促进DC细胞的成熟,口服βGlus/mOVA@LNP能够引起更强的免疫应答。
作者对比了口服βGlus/mOVA@LNP与静脉注射mOVA@LNP引起的免疫反应,并以CD11c的表达表征DC细胞的成熟度。在肠系膜淋巴结中,即使是mEGFP,带有βGlus的LNP都能够使成熟DC细胞的比例升高,因此可以认为βGlus作为佐剂可以促进DC细胞的成熟(Fig. 5B)。CD107α是一种溶酶体相关膜蛋白,可以用于评价T细胞的杀伤毒性。在脾脏中,统计表达CD107α的T细胞比例发现,,口服βGlus/mOVA@LNP相较于静脉注射mOVA@LNP,激活了更多具有杀伤性的T细胞,因此作者认为βGlus/mOVA@LNP可以引起更强的特异性免疫(Fig. 5C)。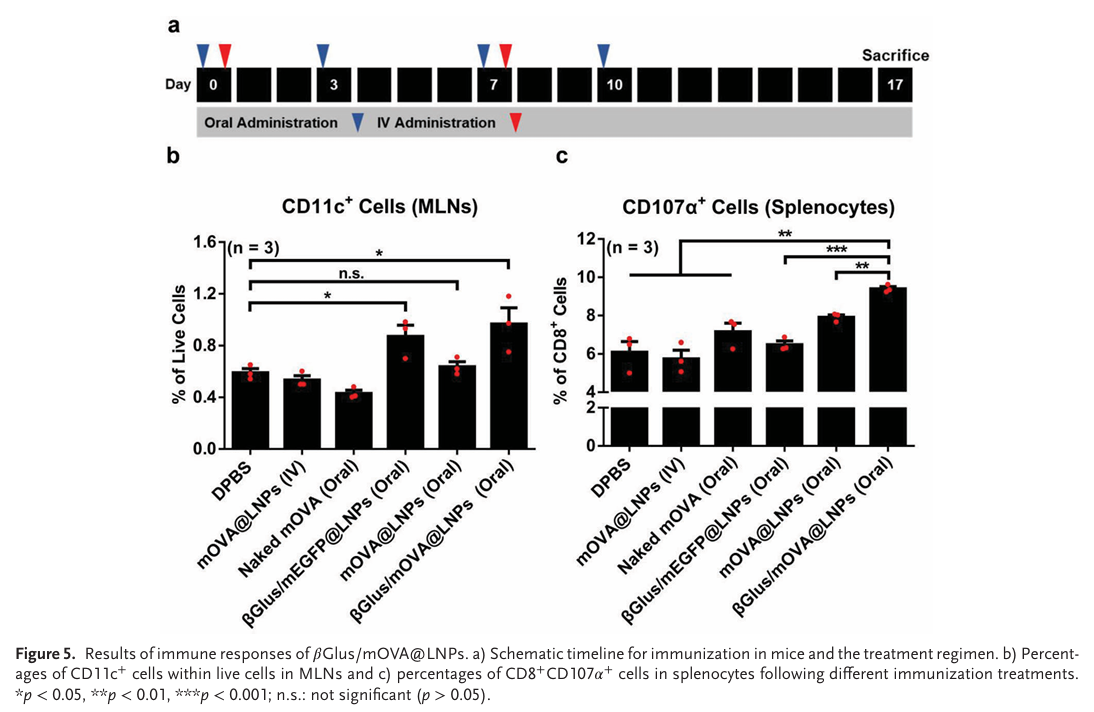
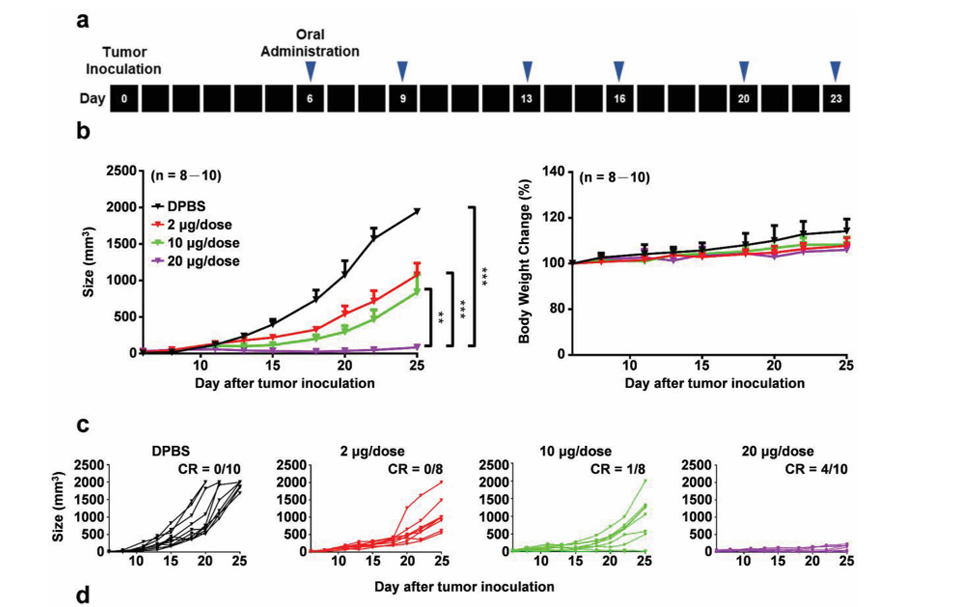
5.口服βGlus/mOVA@LNP对肿瘤的治疗效果
结论:口服βGlus/mOVA@LNP可以有效抑制肿瘤生长。
在小鼠皮下接种了E.G7-OVA肿瘤细胞构建了肿瘤模型,并首先测试给药剂量对肿瘤治疗的影响(Fig. 6A)。结果发现,口服给药有剂量依赖效应,20 μg的剂量下,肿瘤生长受到显著抑制,且存在最多肿瘤完全消退的个体(Fig. 6B,C)。随后,为对比口服与注射给药方式差异、验证β-Glus在抑制肿瘤中的作用,作者进行了进一步实验,(Fig. 6D),结果发现,口服βGlus/mOVA@LNP肿瘤体积显著减少,减少程度最大,且完全消退个体更多(Fig. 6E,F)。由此说明口服βGlus/mOVA@LNP相较于注射给药可以有效抑制肿瘤生长,且加入βGlus效果优于mOVA@LNP。
6.βGlus/mOVA@LNP的安全性
结论:βGlus/mOVA@LNP不会损伤器官,对器官功能不造成影响。
对口服βGlus/mOVA@LNP的小鼠主要器官进行H&E染色及肝肾指标检测(Fig. 7),发现小鼠主要器官及肝肾功能没有受到影响。这一结果表明该给药方式有较高的安全性。
7.文章总结:βGlus能够结合mRNA并于低pH环境下保持其稳定;βGlu/mRNA@LNP能够激活胃肠道(GI)免疫应答并降低肿瘤大小且给药安全性高。
βGlus/mRNA@LNP可通过微流控的方式合成,其中βGlus的羟基与mRNA的氨基在中性环境下相互反应形成复合物(Fig. 2B),而在酸性条件下,mRNA与βGlus部分解离,当环境pH恢复至中性时,mRNA与βGlus重新结合(Fig. 1)。作者在这篇文献的工作中,另辟蹊径,采用更简便的口服给药方式。βGlus/mRNA@LNP通过口服进入胃肠道后,可以被DC细胞自主摄取,也可进入一些非抗原呈递细胞。DC细胞迁移至肠系膜淋巴结,递送抗原,激活T细胞,引起免疫反应杀死肿瘤细胞(Fig. 1)。该工作为LNP疫苗的开发及给药方式上提供了全新的思路。
































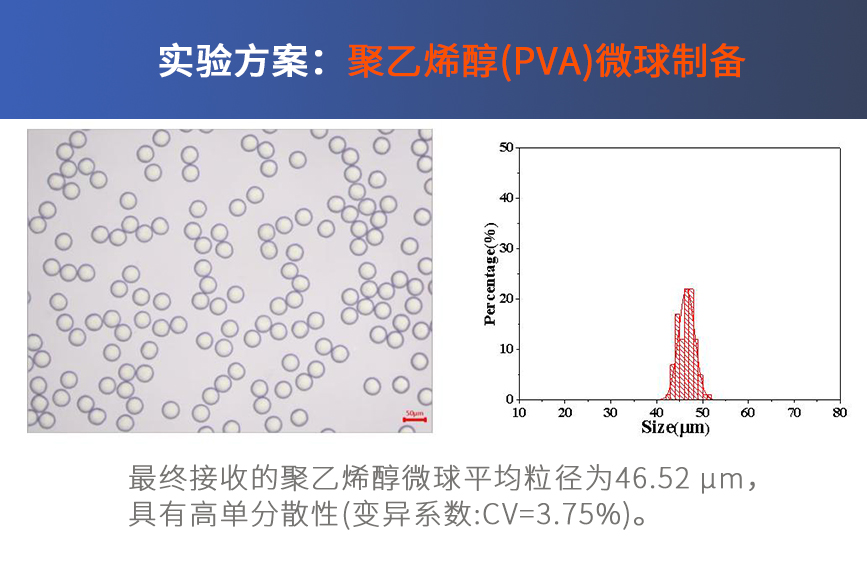
![图5. 基于微流控的冻融循环制备PVA微球[5]](https://cnfluidiclab.oss-cn-shanghai.aliyuncs.com/wp-content/uploads/2025/08/pic-5.png)