实验目的:
本实验方案通过利用微滴/微球制备仪,以5%PLGA (聚乳酸-羟基乙酸共聚物)-二氯甲烷溶液为内相,以2% HAMA(甲基丙烯酰化透明质酸)溶液(含0.5% LAP作为光引发剂)为中间相,以2% Drop-Surf微滴生成油为外相,采用FluidicLab双乳化玻璃微滴芯片制备双核双乳液滴,并通过405 nm紫外光照射实现微滴的固化,最终获得PLGA-HAMA核壳结构微球。
引言:
油包水包油O/W/O双乳核壳结构微球可有效的将目的物,如生物活性化合物、药物或功效成分,封装在特定区域内,并最终根据需要在合适的时间和地点释放封装的目的物,其在食品配方、药物递送和化妆品领域有着广泛的应用前景。
在食品配方中,O/W/O型核壳结构微球将生物活性化合物有效封装,以提高抗氧化潜力、生物利用度和溶解度等方面的能力;在药物递送中,O/W/O型核壳结构微球可以将疏水性药物稳定分散于水中并被输送到靶向位点,避免在储存或针头注射时引起药物的团聚或堵塞;在化妆品领域中,O/W/O型核壳结构微球可以将防晒剂、植物油或功效成分被高分子聚合物完全包裹起来,以达到增加包裹物稳定性和缓释的效果。
通常,O/W/O型核壳结构微球是用含两种性质不同的表面活性剂的分散相分两步制备,并最终实现固化而获得。常规的制备方法包括传统的机械搅拌乳化法、静电喷雾法和膜乳化法等方法。上述方法所制备的核壳结构微球粒径分布较宽,且内部结构较难控制。这对敏感性成分包裹率、药物的降解和释放速率控制有很大影响。
基于此,FluidicLab通过利用微滴/微球制备仪,以5%PLGA-二氯甲烷溶液为内相,以2% HAMA溶液(含0.5% LAP作为光引发剂)为中间相,以2% Drop-Surf微滴生成油为外相,采用FluidicLab双乳化玻璃微滴芯片制备双核双乳液滴,并通过405 nm紫外光照射实现微滴的固化,最终获得PLGA-HAMA核壳结构微球。
实验材料:
| 试剂
|
微滴生成油 (Drop-Surf, FluidicLab) |
| 破乳剂 (Drop-Surf, FluidicLab) | |
| PLGA粉末 (FluidicLab, 50/50, Mw:2w) | |
| 甲基丙烯酰化透明质酸 (HAMA, FluidicLab) | |
| 苯基(2,4,6-三甲基苯甲酰基)磷酸锂盐 (LAP, FluidicLab) | |
|
耗材
|
15 mL离心管(Falcon 15 mL REF 352097)若干 |
| 1.5 mL黑色离心管和透明离心管若干 | |
| 内/外径0.25 /1.6 mm PEEK管及所需接头 | |
| 10 mL棕色玻璃瓶若干 | |
| 0.22 μm针式过滤器(PTFE材质)若干 | |
| 2 mL注射器若干 | |
| 1.8 mL避光样品管 | |
| 芯片夹具
|
GL-DE-100-150双乳化玻璃芯片 (FluidicLab) |
| 玻璃双乳化微滴芯片夹具 | |
| 设备 | Fluidiclab微滴/微球制备仪(三通道) |
| 辅助设备
|
电脑(Win10 以上系统) |
| 高速离心机(湖南湘仪, H1850) | |
| 普通光学显微镜(用于测微球粒径) | |
| 超声波清洗机(语盟,YM-020T) | |
| 常规紫外灯(405 nm光源) | |
| 电子分析天秤(力辰科技) |
实验步骤:
-
试剂准备:
- 5% PLGA-二氯甲烷溶液(w/w)配制(内相溶液):
称取0.1 g PLGA粉末,加入1.43 mL 二氯甲烷(约1.9 g),超声溶解。用0.22 μm滤膜过滤。
- 4%HAMA水溶液(w/w)配制:
称取0.04 g HAMA粉末,加入0.96 g超纯水,避光超声振荡溶解。
- 1% LAP水溶液(w/w)配制:
称取0.050 g LAP粉末,加入4.95 g超纯水,避光超声振荡溶解。
- 中间相溶液配制(2% HAMA+0.5% LAP):
取500 μL 4%HAMA溶液,500 μL 1% LAP溶液,避光振荡均匀,并用0.22 μm针式过滤器过滤。
-
PLGA-HAMA核壳双乳化微球的制备:
(1) 微滴/微球制备仪的安装连接
微滴/微球制备仪安装连接参考《微滴/微球制备仪使用手册V.1.0》中“2. 微滴/微球制备仪的安装连接”的部分;其连接如下(步骤③-⑦连接效果如下图所示):
① 用气管依次连接“空气压缩机”--“气源处理装置”--“微滴/微球制备仪”;
② 将微滴/微球制备仪分别与电源、电脑的连接;
③ 用气管分别将A0(压力输出通道一)和A1(内相1.5 mL黑色离心管储液池),B0(压力输出通道二)和B1(中间相1.5 mL黑色离心管储液池)连接,C0(压力输出通道三)和C1(外相的15 mL储液池);
④ 用配有1/4-28螺纹接头和卡箍的PEEK管(内/外径 0.25 mm/1.6 mm)分别将A1(内相1.5 mL黑色离心管储液池)和A2(通道一流量传感器),B1(中间相1.5 mL黑色离心管储液池)和B2(通道二流量传感器)连接,C1(外相的15 mL储液池)和C2(通道三流量传感器)连接;
⑤ 用配有1/4-28螺纹接头和卡箍的PEEK管(内/外径 0.25 mm/1.6 mm)分别将A2(通道一流量传感器)和A3(双乳化微滴芯片内相入口),B2(通道二流量传感器)和B3(双乳化微滴芯片内中相入口)连接,C2(通道三流量传感器)和C3(双乳化微滴芯片外相入口)连接;
⑥ D为标准PDMS芯片和夹具的组合,芯片和夹具的入口通过硅胶塞密封;
⑦ 用PEEK管(内/外径 0.25 mm/1.6 mm)将芯片出口E处生成的乳液导出。
(2) FluidicLabSuite软件的安装和设备的添加:
FluidicLabSuite软件的安装参考《微滴/微球制备仪使用手册V.1.0》中“3.1 FluidicLabSuite软件的安装”的部分;
(3) PLGA-HAMA核壳双乳化微滴的制备和固化
具体操作步骤如下:
① 分别在1.5 mL内相黑色离心管储液池(通道一)、1.5 mL中相相黑色离心管储液池(通道二)和15 mL外相储液池中依次加入上述配制的内相溶液、中间相溶液和5 mL微滴生成油;
② FluidicLabSuite软件的设备添加参考《微滴/微球制备仪使用手册V.1.0》中“3.2 FluidicLabSuite软件的设备添加”的部分(相机和流量传感器仅需添加一次);
③ 打开空气压缩机和气源处理装置开关;
④ 在乳液出口端放置离心管接收微滴稳定前的废液;
⑤ 在电脑端设置通道一压力(内相,如190 mbar)、通道二压力(中间相,如280 mbar)和通道三压力(外相,如500 mbar)排出管路和芯片中的空气;
⑥ 待管路和芯片中完全填充液体后(空气被完全排出);设置内相、中间相和外相压力依次为75、200和80 mbar,在此压力下稳定生成双核双包裹液滴;
⑦ 用疏水培养皿接收一滴乳液,并在普通光学显微镜下观察其微滴的均匀性;
⑧ 待微滴生成均匀后,即可开始接收至透明的1.5 mL离心管中;
⑨ 30 min后停止收集,密封于离心管中,用405 nm紫外灯照射5 min固化。
-
PLGA-HAMA核壳双乳化微球的破乳清洗:
具体操作步骤如下:
① 去除1.5 mL离心管底部微滴生成油;
② 按V球:V破=1:2 加入破乳剂,振荡破乳;
③ 1000 rpm离心处理1 min,并去除底部破乳剂;
④ 重复上述②和③操作;
⑤ 在离心管中加入PBS缓冲液,振荡离心多次洗涤处理;
⑥ 最终得到固化后的HAMA微球,分散在PBS缓冲液中。
注意:若含有球的水相中仍有部分油乳液存在,可通过细胞筛过滤去除油的乳液或者离心后从上部取出含有微球的水相。
-
微滴/微球制备仪清洗:
微滴生成仪每次使用完必须清洗管路、流量传感器和芯片。具体操作详见“微滴/微球制备仪操作指导卡”。
结果与讨论:
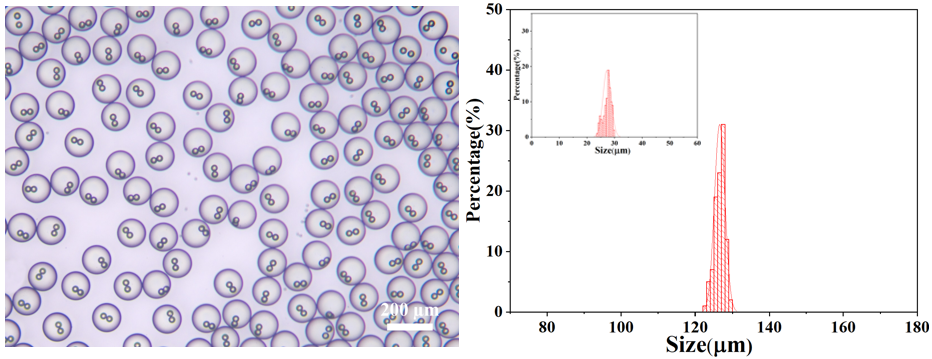
刚接收的PLGA-HAMA核壳双乳化微滴核壳的平均粒径分别为27.29和126.56 μm,其变异系数CV分别为5.34%和1.12%。其显微镜图和核壳粒径分布(插图为核粒径分布图)如下图所示:
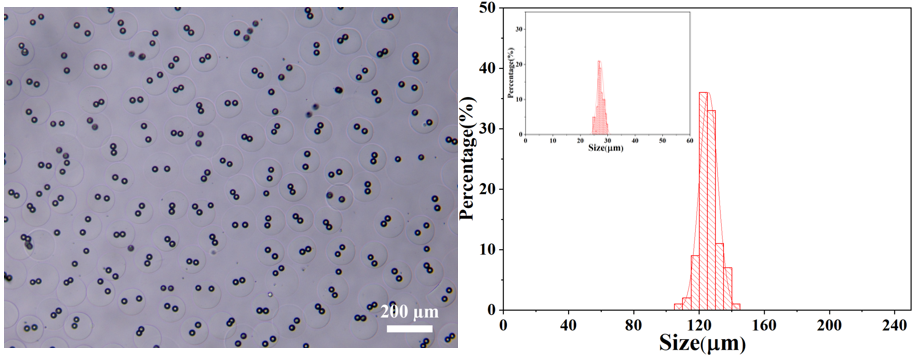
最终获得PLGA-HAMA核壳双乳化微球核壳的平均粒径分别为27.32和125.77 μm,其变异系数CV分别为4.38%和4.53%。其显微镜图和核壳粒径分布(插图为核粒径分布图)如下图所示:
实验关键要点:
- 采用本方案制备PLGA-HAMA核壳微球时,由于2%(wt%)HAMA黏度大于Drop-Surf微滴油,因此在同样流速下,挤压水相所施加的压力大于油相的压力,具体可参考本方案所对应的视频(压力数值仅供参考);
- HAMA水相溶液在配制和使用时必须避光操作,须使用棕色或黑色离心管;
- 由于二氯甲烷见光易分解和沸点低等特点,PLGA的二氯甲烷溶液在使用时必须避光放置冰水浴中,以避免微滴生成过程中气泡的产生。