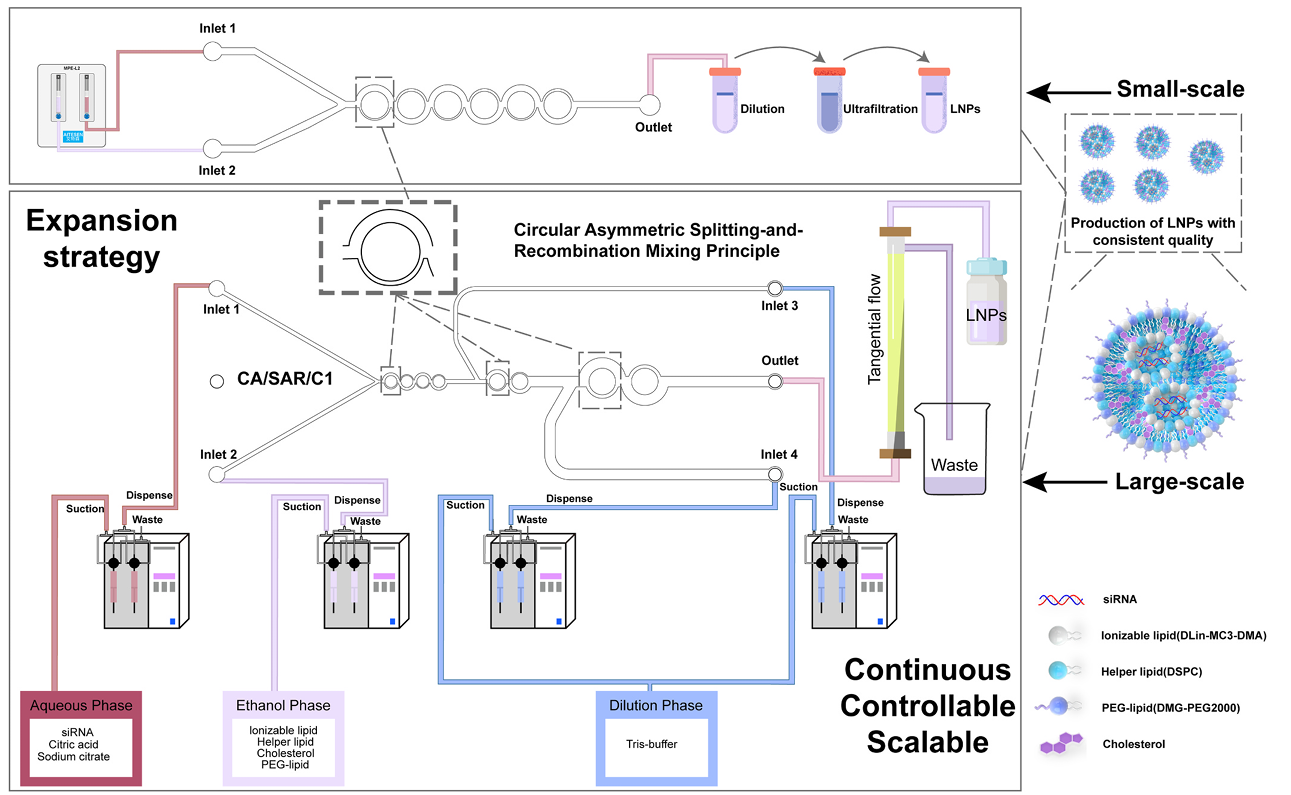
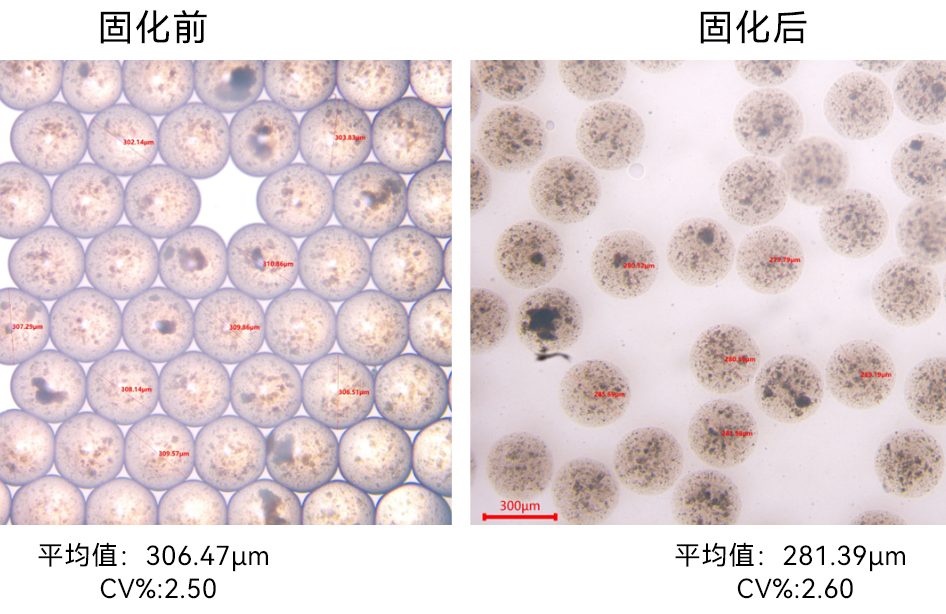
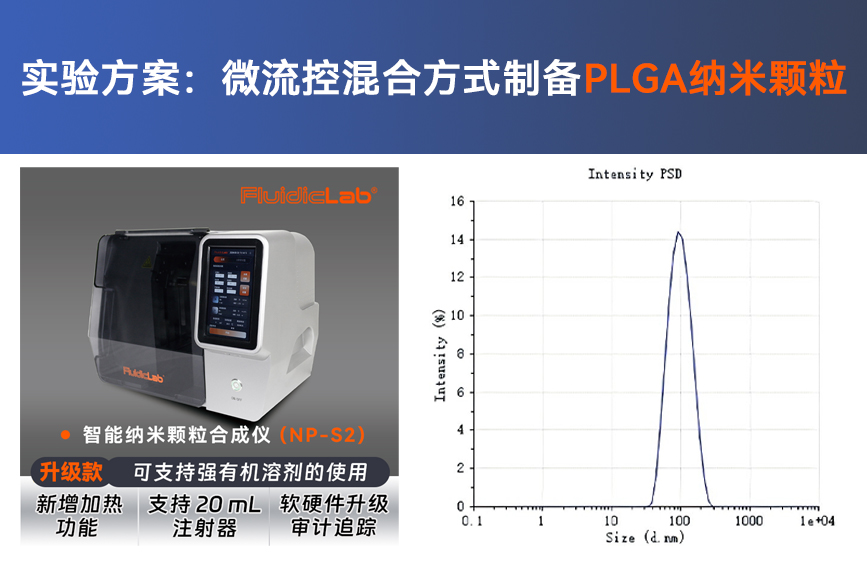
本文延续本网站上一篇文章:
本系列总体章节目录:
章节二、使用hiPSC的中枢神经系统体外模型:优势和挑战
来源于健康人和患者的体细胞可被重编程为干细胞,这些干细胞可再分化为特定细胞类型,移植到患者体内(Sa´nchez Alvarado and Yamanaka, 2014)。然而,将hiPSC应用到中枢神经系统治疗中仍面临巨大的挑战(Braganc¸a et al., 2019;Ortuno-Costela et al., 2019)。这些挑战一方面由于脑组织结构上的复杂性,另外一方面是因为免疫反应(即使是在自体来源的情况下),往往导致中枢神经系统移植失败(Zhao et al., 2011;Nikolakopoulou et al., 2016;Garreta et al., 2018)。这些体内尝试的结果充分证明了建立有效的个性化中枢神经系统体外模型的必要性。
来自正常和病患的hiPSC已被用于模拟人类脑组织,以阐明其在正常和病理环境中的功能和机制。hiPSC与器官芯片结合,使研究人员能够复现人类中枢神经系统的复杂结构,如血脑屏障 (Vatine et al., 2019)。基于hiPSC的脑芯片设备通常被用于研究神经发育和神经退行性病变,为再生医学、毒理学和高通量研究进展做出了重大贡献 (Berg et al., 2019)。但是,在研究人员试图将hiPSC细胞整合到体外平台中时,仍然面临着多种障碍。
目前构建基于hiPSC的先进体外模型面临的挑战:
1. 供体多样性和细胞异质性
供体多样性是原代细胞共有的特征,是构建hiPSC体外模型中的主要障碍。在重编程和分化过程中残余的表观遗传记忆、特殊的遗传背景导致了hiPSC衍生细胞系之间的巨大多样性 (Kim et al., 2010, 2011;Polo et al., 2010;Bar-Nur et al., 2011;Boland et al., 2014)。由于不完全的重编程,一些hiPSC细胞系显示出增殖和分化潜能的缺陷 (Ohnuki et al., 2014)。
2. 分化步骤、重复性和细胞成熟度
可靠的模型需要高质量的hiPSCs和有效的分化方案,以达到预期的细胞命运。因此,学术界和工业界的研究人员一直致力于开发中枢神经系统谱系特异性分化步骤。然而,对纯细胞和成熟细胞类型的需求在很大程度上仍未得到满足。这些细胞经常表现出不成熟的、具有胚胎组织属性的特征。这些细胞可以作为神经发育和早发性疾病研究的良好模型,但不能充分模拟晚发性疾病和成熟组织 (Miller et al., 2013)。一些研究已经报道了由于残留的表观遗传记忆,hiPSCs偏向于分化为特定谱系的细胞。通过增加分化前的传代数,可以将这些细胞重置为多潜能模式 (Polo et al., 2010;Bar-Nur et al., 2011;Kim et al., 2011;Boland et al., 2014;Kedziora and Purvis, 2017;Doss and Sachinidis, 2019)。总的来说,为了提高基于iPSC的体外模型的可转化性,生产高质量的hiPSCs仍然是一个关键问题。
3. hiPSC来源细胞的免疫原性
早期在动物身上进行的研究 (de Almeida et al.,2014;Zhao et al., 2015)表明,分化细胞的免疫原性低于相应的iPSC群体。因为hiPSC可以规避生理免疫反应,避免患者的排斥反应,hiPSC来源的组织可以取代自体组织移植。然而,也有证据表明,hiPSC衍生的体外模型可能缺乏预测免疫反应方面的能力。在这种情况下,hiPSC衍生的模型无法很好地模拟脑组织中免疫介导的疾病,从而阻碍了药物的成功开发。
4. 使用基于hiPSC构建神经退行性疾病模型
使用hiPSCs对单基因疾病建模较为准确,但对于复杂的,多基因疾病和散发性疾病建模仍较困难。迄今为止,对于复杂的多基因疾病的研究方法是将患者和来自同一家族的健康成员进行比较;病变通常归因于同一家族中健康和病人比较后得到的突变,从而找到疾病原因。这种方法可以防止研究人员将疾病相关的变异与由其他因素引起的变异混淆起来。由于大多数神经退行性疾病都是散发性的,有必要使用大量患者来源的hiPSC来降低研究的信噪比,提高结果的准确性(Doss and Sachinidis, 2019)。此外,hiPSC衍生的细胞通常被用于2D培养,因此缺乏三维空间的相互作用;工程化的3D培养模型提供了类似于体内的环境,以方便研究遗传和环境线索如何影响疾病(Sharma et al., 2020)。
5. hiPSC来源细胞的区域特性
人类中枢神经系统的复杂性来自于多个神经细胞亚型之间的相互作用。而大多数神经系统疾病源于特定细胞亚型的缺陷,其潜在机制在很大程度上仍难以确定 (Imaizumi et al., 2015)。因此,准确的疾病建模需要使用具有特定区域特性的分化细胞。事实上,世界各地的研究人员已经使用来自患者的hiPSCs来研究几种神经系统疾病,包括肌萎缩性侧索硬化症(ALS)、阿茨海默病、精神分裂症和帕金森病 (Cooper et al., 2010;Zhang et al., 2014;Ahmad et al., 2018;Fujimori et al., 2018;Henstridge and SpiresJones, 2018;Li et al., 2018;Mishima et al., 2018, Osaki et al., 2018c;Ishii et al., 2019;Penney et al., 2020)。在这些研究中,hiPSCs被分化为不同的细胞类型,从而提供了具有区域特征的细胞疾病模型。然而,由于目前的分化方案在高纯度培养各种神经元亚型方面的能力有限,在这些研究中获得的结论仍有很大的不确定性。
6. 对通用培养基的需要
对于基于器官芯片和iPSC衍生的体外模型来说,一个重要的问题是需要一种“通用培养基”。为了有效地模拟脑组织的多样性,经常需要共培养几种细胞类型。但是不是每个细胞都能在相同的培养基中生长,并对相同的生长因子或分化因素作出反应 (Pavlovich, 2018)。因此,需要研发无异源成分、组分明确的培养基,以支持iPSC衍生的细胞的生长和分化。
章节三、类器官/器官芯片中枢神经系统体外模型介绍
微流控芯片的基本功能是创造一个各种细胞物理上相互分隔,但仍然可以相互作用的平台,从而实现在体内模型中无法实现的连续观察。这种分隔和相互联系可以通过连接几个器官芯片或在一个微流控芯片上集成多个单元实现。
将神经元胞体体与延伸的神经突进行物理分隔的概念首先由 Campenot提出 (Campenot, 1977)。2003年,Taylor等首次利用微流控技术,在细胞培养室中加入微凹槽;研究人员从而将神经元胞体和神经突触物理分开,并使用该系统来研究神经突触的局部损伤 (Taylor et al., 2003;Neto et al., 2016)。2005年Taylor率先开发了一种基于微流体的体外平台来研究损伤后的轴突再生 (Taylor et al., 2005)。Park进一步改进了该设备,以研究神经元-胶质细胞之间的相互作用和轴突髓鞘形成 (Taylor et al., 2005;Park et al., 2006, 2009a, 2012;Higashimori and Yang, 2012;Shi et al., 2013)。为了阐明髓鞘形成机制,科学家在同一系统内共培养神经元和神经胶质细胞,并应用于脱髓鞘疾病(多发性硬化症)的治疗策略研究 (Park et al., 2009b;Yang et al., 2012;Shi et al., 2013)。后续开发的系统将免疫细胞、hiPSC来源的小胶质细胞、hiPSC来源的少突胶质细胞也整合进来,旨在揭示人类脱髓鞘脑组织中发生的复杂细胞过程 (Abud et al., 2017;Douvaras et al., 2017;Haenseler et al., 2017;Pandya et al., 2017;Garcia-Reitboeck et al., 2018;McQuade et al., 2018)。
在多芯片设计中,几个器官芯片连接在一起,模拟神经组织复杂的细胞结构。例如,在人类神经血管单元(NVU)的模型中,通过将三个芯片联通在一起,揭示了内皮细胞和神经元细胞之间的代谢耦合(Maoz et al., 2018)。
微流体技术也被广泛用于探索生化因子如何影响轴突生长、寻径和突触功能(Wu et al., 2005;Cox et al., 2008;Taylor et al., 2009;Gumy et al., 2011;Park et al., 2014;Kung et al., 2015;Deglincerti et al. (2015)。Deglincerti利用轴突与神经元体细胞的物理分离,表明生长锥与局部蛋白质合成/降解的紧密联系。该研究表明,生长锥表现出整体泛素化水平的升高,并且蛋白降解复合体特异的降解生长锥特异表达的蛋白。因此,作者认为,轴突中引导信号的调节包含了局部特异表达蛋白的合成和降解 (Deglincerti et al., 2015;Neto et al., 2016)。
除了可以培养细胞群,并使细胞之间互相联系,器官芯片也可控制大量的机械特性如材料刚度、形状约束、间隙流和剪切应力,来研究他们对细胞状态和分化的影响 (Sundararaghavan et al., 2009;Peyrin et al., 2011;Song and Munn, 2011;Kim et al., 2013;Galie et al., 2014;Hattori et al., 2014;Asano et al., 2015;Osaki et al., 2018a)。各种生化因子也可以很容易施加在器官芯片上,以对神经发育过程的机制进行研究。通过操纵细胞因子的浓度梯度,如BMP4、SHH、FGF、RA和WNT3,即可协调细胞在早期脑组织发育中增殖、分化和器官发生 (Park et al., 2009b;Demers et al., 2016;Uzel et al., 2016;Osaki et al., 2018a)。
二、利用微流控系统来重现不同大脑区域及其连接
人类的大脑由250多个不同的区域组成,每个区域都有特异性的ECM、结构和功能(Dauth等(Novak and Kaye, 2000;Lau et al., 2013;Dauth et al., 2016)。高级的大脑功能,以及许多神经精神疾病,受海马、丘脑、小脑和杏仁核等多个大脑区域的相互作用调节 (Kato-NegiShi et al., 2013)。因此,在体外模拟不同脑区的连接具有重要意义。目前,只有少数的体外模型包含了来自两个或多个不同脑区的细胞 (Kanagasabapathi et al., 2011;Peyrin et al., 2011;Kato-NegiShi et al., 2013;Dauth et al., 2017;Soscia et al., 2017)。Peyrin等人报道了一个微流控系统,重建了一个具备功能和同步化的皮质-纹状体定向网络。使用双腔室的微流控装置培养小鼠原代皮质和纹状体神经元,并使它们通过轴突连接 (图2 A) (Peyrin et al., 2011)。研究人员借此观察到,皮质神经元触发了多刺纹状体神经元的分化和树突棘的形成。另外一种类似的微流控装置也被用于研究皮质和丘脑之间的相互作用 (Kanagasabapathi et al., 2011);基于微流控芯片的系统操作简单,可以实现体内系统中难以实现的功能(如单独研究皮质-丘脑相互作用的能力,而不受其他区域的影响。在该模型基础上开发的体外模型可以生长神经突,连接两种不同的脑组织,进行电生理和免疫组化分析(Kanagasabapathi et al., 2012)。通过使用这个体外系统,作者证明了群体放电起源于皮层区域,然后触发了皮层-丘脑网络,证实了之前从体内实验中得到的结论。
Kato-Negishi等开发了一个毫米大小的三维神经元芯片,由大鼠海马和皮质细胞形成。在这个模型中可进行Ca2+成像、基因转导和免疫组化,它能够显示皮质和海马神经元之间的投射和突触的形成,能够在体外研究多个大脑区域之间的相互作用。类似地,Soscia等人开发了一个共培养海马和皮质神经元的平台(图2 B),用于研究不同的大脑区域如何建立连接、整合神经网络和增加它们的放电率。最近,Dauth等首次开发了包含三个脑区域的体外中枢神经系统模型,体外培养的大鼠前额叶皮层、海马和杏仁核来源的组织通过轴突实现连接(图2 C)。该模型充分证明在体外连接不同的大脑区域的重要性,与培养单类型细胞相比,共培养的细胞在细胞组成、蛋白质表达和电生理特性上均表现出很大的差异。该体外模型被用于模拟皮质边缘系统,并检查盐酸苯环利丁(PCP)对一个大脑区域的影响,并确定其他区域的反应。
图1、多个脑区的体外培养。(A)在芯片内生长的皮层(绿色)和纹状体(红色)神经元和对应的免疫荧光显微图。(B)新型多电极阵列,用于共培养原代海马和皮层神经元。(C)大脑芯片模型示意图,包括三个不同的大脑区域,前额叶皮层,海马体和杏仁核,微管蛋白III(绿色)和GFAP(红色)。(D)微流控装置的示意图,允许代谢耦合神经元和内皮细胞。
三、模拟血脑屏障
中枢神经系统模型不仅要模拟大脑复杂的神经元结构和功能,还需要考虑其独特的血管系统。中枢神经系统中血管内皮紧密连接,空洞极少,内皮细胞胞吞率非常低(Abbott et al., 2006)。大脑的血管系统包括一个高度特化的内皮细胞组成的血脑屏障,血脑屏障严密控制化合物进入大脑。因此,体外模型如果需要理解大脑对各种刺激的反应,就必须模拟由血脑屏障和血管周围系统组成的NVU与脑周细胞、星形胶质细胞和神经元密切相互作用。一般来说,确保一个给定的分子能够穿透血脑屏障,从而进入中枢神经系统是中枢神经系统药物开发中的一个主要挑战 (Herland et al., 2020)。在小分子药物开发中,计算药物分布和动物模型已经取得部分成功,但大分子生物药的快速发展,对大分子药物穿透血脑屏障模型的需求更大 (Gribkoff and Kaczmarek, 2017).
已经开发出了几种体外模型来模拟NVU(总结见表2)。最近的一个模型将一个血脑屏障芯片连接到一个脑芯片,然后连接到第二个血脑屏障芯片,其中三个芯片中包含人类BMEC、神经元细胞、胶质细胞和周细胞(图2 D)。他们使用这个系统来分析组成NVU的单个细胞类型以及神经活性药物血管内给药的效果(Maoz et al., 2018)。
在体外建模时,要充分考虑到NVU和血脑屏障的特性。体内血脑屏障特性的评估是通过测量跨内皮电阻(TEER)、对小化合物的被动渗透性 (<1000 g/mol)以及外排和内流转运蛋白的活性 (Lippmann et al.,2012;Stebbins et al., 2016)。影响这些特性的一个关键因素是构建模型的细胞来源。原代人类BMEC保留了一些血脑屏障表型。但是,人类原代BMECs的TEER(通常不超过 200 Ω /cm2 (Mackic et al., 1999;Zenker et al., 2003)。这只有大鼠和青蛙体内TEER测量值的10% (Crone and Olesen, 1982;Butt et al., 1990)。2012年以后,随着hiPSC的出现,相关研究报道了hiPSCC衍生的BMEC样细胞的TEER值为>200Ω /cm2(Lippmann et al., 2012)。但是这些BMEC细胞的性质尚存在争论。
实时监测微流控芯片上NVU的主要指标得到了广泛的关注。研究人员已经在2D和3D细胞培养芯片中整合了二维渗透率和TEER测量 (Booth and Kim, 2012;Walter et al., 2016;Wang et al., 2017;Brown et al., 2015, Xu et al., 2016a;Partyka et al., 2017)。在体外构建NVU模型时,需要考虑一些重要因素:
1. 细胞与细胞间相互作用
共培养NVU细胞为体外模型增加了另一个层次的复杂性,使该模型能够更真实地重现体内条件。BMECs与中枢神经系统细胞共培养有助于重现内皮细胞的血脑屏障特性(通过强化紧密连接和极化转运体的表达) (Kasa et al., 1991;Megard et al., 2002;Didier et al., 2002, 2003;Haseloff et al., 2005;Lippmann et al., 2012;Herland et al., 2016;Hollmann et al., 2017)。此外,研究表明,星形胶质细胞和BMECs分泌的因子可以促进彼此成熟(Janzer and Raff, 1987;Fukushima et al., 2009;Blanchette and Daneman, 2015).。
Transwell模型(表2)已广泛用于BMECs与中枢神经系统和非中枢神经系统细胞共培养;该模型允许无创TEER测量、渗透性分析和外排的评估 (Zenker et al., 2003;Colgan et al., 2008;Helms et al., 2014;Labus et al., 2014;Canfield et al., 2017;Delsing et al., 2018)。然而,这种方法反映的是单层非连续细胞的静态环境,因此不能完全重现体内血脑屏障的环境。
2. 血流
血液流动是开发NVU模型中应该考虑的一个重要参数。毛细血管中内皮细胞成熟与其受到的剪切应力密切相关。
Siddharthan等人的研究显示,BMECs中剪切应力与紧密连接蛋白ZO-1的上调存在相关性。2011年, Cucullo报道了剪切应力对BMECs转录组的影响;剪切应力会诱导紧密连接/粘附连接、耐药转运相关基因的表达 (Cucullo et al., 2011)。
器官芯片的出现使研究人员能够在体外观察血流刺激下血管和其他细胞的功能。HBooth和Kim首次使用含有脑内皮和星形细胞系的NVU微流控芯片模型,证明片上有血流灌注的NVU的TEER高于静态水平,NVU对示踪剂的渗透性也表现出类似体内的水平。更深入的研究表明,芯片上NVU比transwell模型表现出更低的渗透性(Prabhakarpandian et al., 2013;Walter et al., 2016;Partyka et al., 2017)。
3. 细胞外基质
在体外模拟ECM是一个巨大的挑战(Rauti et al., 2019);ECM成分在整个大脑中都有所不同。不同的脑区具有独特的ECM组成,且脑血管ECM不同于脑ECM。脑血管系统中的BMEC在发育阶段的信号分子为纤维连接蛋白,成熟后改变为层粘连蛋白 (Herland et al., 2016;Adriani et al., 2017;Linville et al., 2019)。为了在体外再现NVU,应考虑脑血管系统和脑其他组织ECM的差异,以确保NVU在体外模型的准确性和有效性 (Rauti et al., 2019)。
大多数iPSC衍生的BMECs方案联合使用IV型胶原和纤维连接蛋白作为BMEC分化过程中的诱导因子 (Lippmann et al., 2012, 2014;Hollmann et al., 2017)。然而,其他类型的ECM成分也在体外的NVU中使用,如I型胶原蛋白。尽管I型胶原蛋白不存在于人类大脑中,但I型胶原蛋白的成胶特性使其在NVU的3D体外生成中非常有效 (Herland et al., 2016;Partykaet al., 2017;Wevers et al., 2018;Grifno et al., 2019;Linville et al., 2019)。ECM衍生的凝胶已被应用于微流控装置中,为现有的流体模型增加了另一层复杂性(Herland et al., 2016;Adriani et al., 2017;Linville et al., 2019)。
未完待续!