LNP作为新冠疫苗的载体,其表现出了优秀的递送核酸类药物的能力。与传统腺病毒载体(AAV)相比又具有较高的生物安全性和更低的免疫原性。
来自京都大学iPS细胞研究所(CiRA)的Akitsu Hotta教授于2021年在Nature Communication上发表了题为《Low immunogenicity of LNP allows repeated administrations of CRISPR-Cas9 mRNA into skeletal muscle in mice》的文章。他们为治疗杜氏肌营养不良(DMD),采用了LNP递送CRISPR-Cas9系统,编辑了抗肌萎缩蛋白基因的方式进行了治疗。相较于传统的AAV递送反义寡核苷酸(ASO)的方法,具有更低的免疫原性,可以实现重复给药从而达到持续治疗的目的。
1、LNP与AAV递送Luciferase的能力比较
结论:LNP相较于AAV,虽然持续时间短,但起效更快,荧光强度的峰值更高。
在作者的前期工作中,合成并筛选了一种更适用于其实验方案的可电离脂质TCL053,并用其合成LNP(Fig. 1A、B)。作者用LNP包裹Luc-mRNA;用AAV包装Luc-cDNA,同时将两者注射到小鼠的腓肠肌中进行比较。LNP-Luc mRNA在注射2小时即产生可观测荧光,而AAV-Luc cDNA则于7天后才观察到荧光,且前者峰值高于后者,并呈剂量依赖效应(Fig. 1C、D、E)。
2、sgRNA对抗肌萎缩蛋白基因45号外显子跳跃的验证
结论:hEx45 sgRNA #1与hEx45 sgRNA #23联用可以有效实现抗肌萎缩蛋白基因45号外显子的跳跃
抗肌萎缩蛋白44号外显子的缺失会使得其无法正常表达,是DMD患者的病因之一。该情况下,若跳过45号外显子就可以正常表达(Fig. 2B)。作者发现hEx45 sgRNA #1与hEx45 sgRNA #23可以分别剪切抗肌萎缩蛋白基因45号外显子上下游的两个位点(Fig. 2A)。
为了验证两个sgRNA的剪切效率,作者将不同的sgRNA包裹于LNP内,转染病患来源诱导的成肌细胞,使用RT-PCR与Western blot进行检测(Fig. 2C)。结果显示,hEx45 sgRNA #1与hEx45 sgRNA #23的联用可以使45号外显子的跳跃率达到43.6%(Fig. 2D)并使15%的抗肌萎缩蛋白恢复正常表达(Fig. 2E),均优于单独转染。
3.人源抗肌萎缩蛋白异常的小鼠模型的构建
结论:成功构建了hEx45KI-mdx44的小鼠模型,其抗肌萎缩蛋白缺失44号外显子,并具有人源45号外显子,无法正常表达。
作者将小鼠X染色体上的小鼠抗肌萎缩蛋白45号外显子替换为人源45号外显子,敲除44号外显子模拟病患基因型(Fig. 3A)。构建完成的小鼠模型命名为hEx45KI-mdx44。经RT-PCR(Fig. 3B)和测序双重验证(Fig. 3C)。Western blot结果说明,在小鼠中45号外显子的替换不会影响抗肌萎缩蛋白的正常表达,而44号外显子的敲除则使得抗肌萎缩蛋白不表达(Fig. 3D)。经免疫荧光检测,在hEx45KI-mdx44小鼠模型的胫骨前肌中,抗肌萎缩蛋白明显少于hEx45KI小鼠(Fig. 3E)。类似的,hEx45KI-mdx44小鼠模型的腓肠肌重量与肌酸激酶水平都高于正常小鼠与hEx45KI小鼠,代表其肌肉存在病理性缺陷(Fig. 3F、G)。至此hEx45KI-mdx44小鼠模型成功构建,可作为研究DMD治疗方法的理想模型。
4、在hEx45KI-mdx44小鼠模型中LNP递送与ASO的优劣比对
结论:hEx45 sgRNA #1与hEx45 sgRNA #23联用,可以长效稳定地使得模式小鼠表达抗肌萎缩蛋白,效果优于静脉注射ASO
hEx45KI-mdx44小鼠模型中,sgRNA #1与hEx45 sgRNA #23联用相比单独使用,可达到更高的外显子跳跃率(Fig. 4A)。
反义寡核苷酸(ASO)是治疗该类疾病的另一种方式。在给药前期,LNP的外显子跳跃效率虽然略低于静脉注射的ASO,但LNP的治疗效果可以持续更久,达到一年。长期治疗效果、治疗时长皆优于ASO(Fig. 4B)。通过胫骨前肌的Western blot验证,也可以说明LNP相较于ASO具有更稳定更长效的治疗效果(Fig. 4C、D)。
5、在hEx45KI-mdx44小鼠模型中检验LNP的治疗效果
结论:LNP较AAV,具有更低的免疫原性,可以实现有效的重复给药
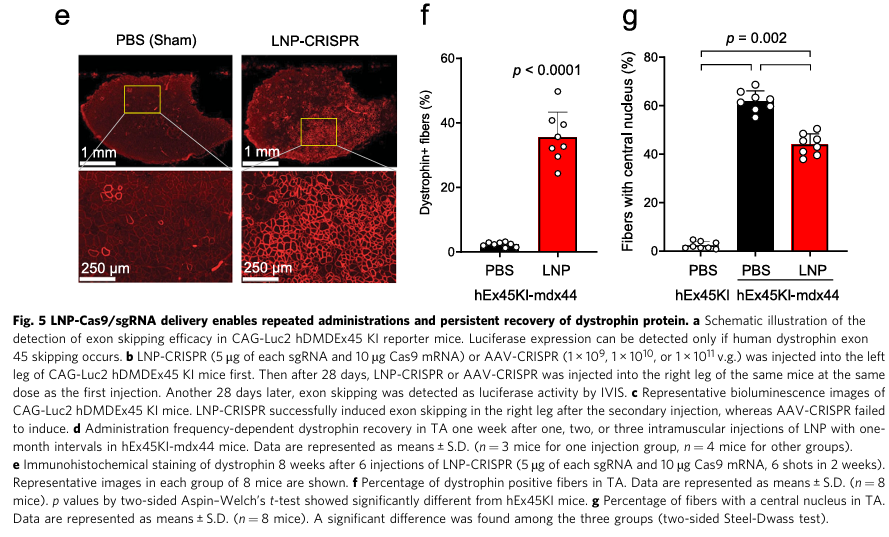
作者在表达Luciferase的小鼠基因中插入人抗肌萎缩蛋白45号外显子的序列(Fig. 5A)以检测敲除效率。以LNP对比传统的AAV载体,同样包裹CRISPR-Cas9系统与两种hEx45 sgRNA,注射入小鼠右腿;经28天后再注射入左腿,再经28天后检测荧光(Fig. 5B)。接受AAV载体的小鼠仅右腿检测到荧光,而LNP注射的小鼠左右腿都具有荧光(Fig. 5C)。AAV在注射后可能因引起免疫反应无法实现有效的二次给药,而LNP具有低免疫原性,可重复给药。
在此基础上,以一个月为间隔重复三次注射LNP,可使抗萎缩蛋白的恢复率从一次的1.1%上升到了4%(Fig. 5D)。免疫荧光、肌纤维与中心核等标志的检测也证明多次注射LNP可以获得较好的治疗效果(Fig. 5E、F、G)。
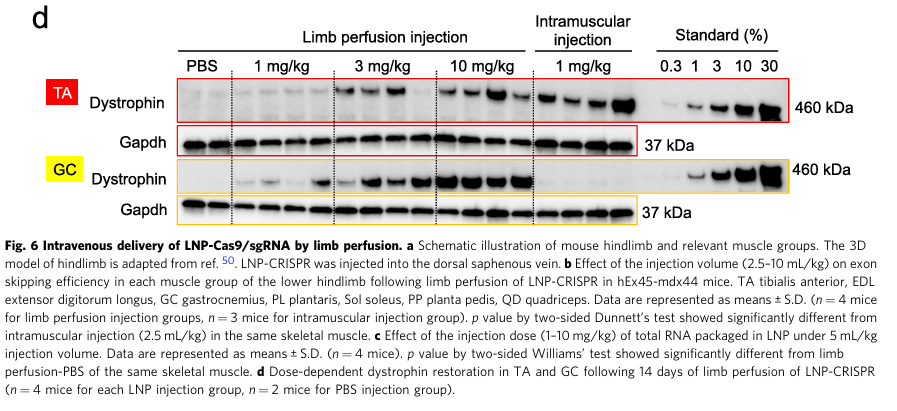
6、LNP-CRISPR注射剂量及注射方式的优化
结论:肢体灌注相较于静脉给药可更广泛地恢复hEx45KI-mdx44小鼠的下肢肌肉抗萎缩蛋白含量
为了验证LNP能否治疗小鼠整个下肢肌群,作者进行了不同注射方式的测试(Fig. 6A),同时比较了不同体积相同RNA与不同RNA相同体积的LNP与静脉注射的差异(Fig. 6B、C),作者将小鼠的股四头肌用止血带捆住后,从背侧大隐静脉注射LNP。肢体灌注中,除了被捆绑的股四头肌外,其余肌肉的抗肌萎缩蛋白基因都有很好的外显子跳跃率,而肌肉注射仅胫骨前肌可以观察到有效的外显子跳跃。Western blot检测腓肠肌与胫骨前肌也可以发现,相应的注射治疗均有剂量依赖效应(Fig. 6D)。
以上是对这篇文献结果的汇总。在新冠疫苗中发挥了重要作用后,LNP作为一种高效的药物递送载体,在其他疾病治疗过程中的应用是目前热门的研究方向。这篇文章中,不仅给出了以LNP-CRISPR治疗DMD的可能性,还说明了LNP在作为递送药物的载体时,拥有更低的免疫原性、起效快等优势,证明了LNP是递送药物的优质载体。



































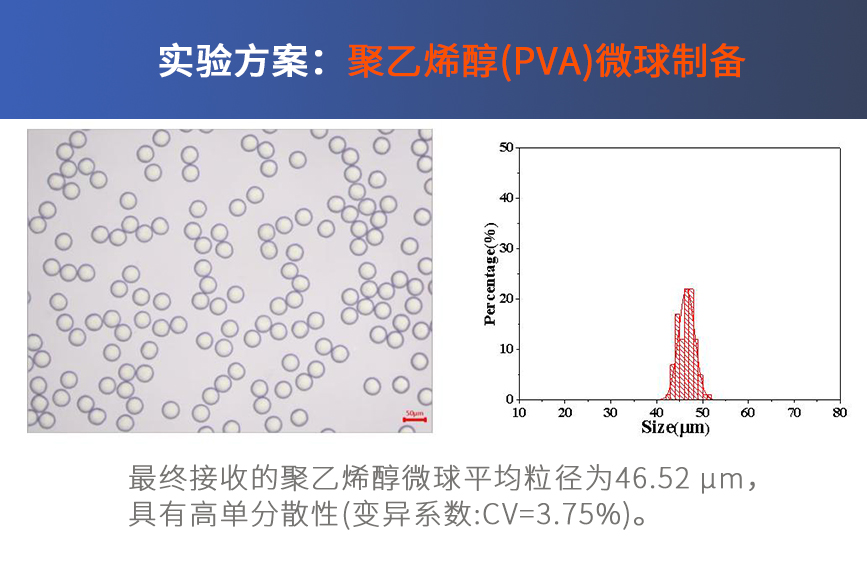
![图5. 基于微流控的冻融循环制备PVA微球[5]](https://cnfluidiclab.oss-cn-shanghai.aliyuncs.com/wp-content/uploads/2025/08/pic-5.png)