实验目的:
参照Moderna和BioNtech的新冠疫苗配方,以ALC-0315、MC3、SM102为主要脂质,制备包载mRNA的脂质纳米颗粒(LNP)。
实验原理:
ALC-0315、MC3、和SM102是三种可用于人体的可解离脂质,在酸性条件下可质子化形成阳离子脂质,通过静电作用和带负电的mRNA结合,形成载有mRNA的脂质纳米颗粒(lipid nanoparticles, LNPs)。本实验中采用微流控混合法,让脂质溶液与和mRNA溶液在微混合器中充分、迅速的形成粒径均一的LNP。由于脂质溶解于乙醇中,核酸溶解于酸性缓冲液中,因此需要透析或者超滤去除残余的乙醇并将溶液体系置换至中性缓冲液中。
伴随设备、试剂、系统升级,我们同步更新了实验方案,可点击下方链接查看新版实验方案:
https://www.fluidiclab.com/mrna-lnp-s1/【实验方案:基于微流控芯片制备核酸脂质纳米颗粒(mRNA-LNP合成为例)(附:LNP合成质量检测、转染细胞等实验方案)】
本篇实验方案仅供已购客户参考。
实验材料:
| 试剂 | ALC-0315、MC3、SM-102 |
| DSPC | |
| DMG-PEG2000/ALC-0159 | |
| CHOLESTEROL | |
| 柠檬酸(C6H8O7•H2O) | |
| 柠檬酸钠(C6 H5 Na3O7•2H2O) | |
| 无水乙醇 | |
| PBS缓冲液(pH7.4)或者 20mM Tris缓冲液(pH7.4) | |
| 耗材 | 3 ml 注射器(BD 302113) |
| 3 ml 注射器(BD 302113) | |
| Millipore 15ml/30kd 超滤离心管 | |
| 微混合芯片 | FluidicLab LNP-B1 |
| 设备 | FluidicLab LNP 合成仪(LNP-S1-L) |
| 动态光散射仪(本文中使用的为 Malvern ZS90) | |
| 冷冻离心机 | |
| Qubit 4.0 |
实验步骤:
1.配制脂质-乙醇溶液:
LNP 的成分与分子量见下表:
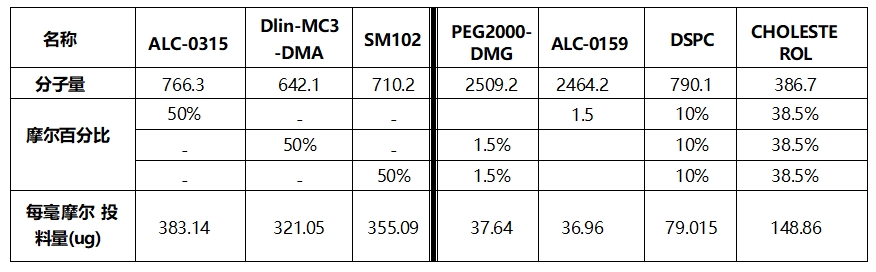
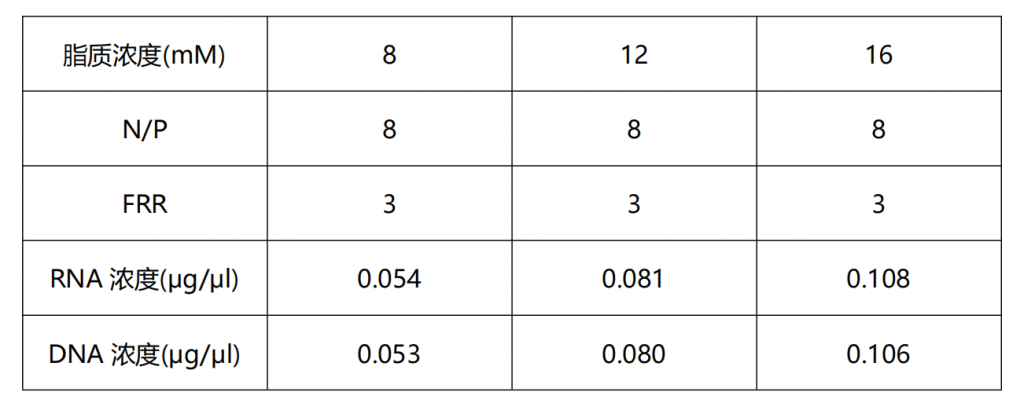
所有成分总浓度配置成12 mM(约7.5 mg/ml)的浓度。如果需要摸索磷脂对LNP最终粒径的影响条件,可以配制以下浓度:8 mM(约5 mg/ml)、12 mM(约7.5 mg/ml)和16 mM(约10 mg/ml)。
备注:阳离子磷脂保存条件比较苛刻,常温下接触空气后会发生氧化变质。直接结果为超滤/透析后LNP粒径出现异常增大(如粒径增大一倍以上)。因此建议对阳离子磷脂进行分装冷冻保存,按照实际使用量按此使用。其它磷脂成分可以用乙醇配置为高浓度母液,短时间内4 ℃或者-20 ℃保存。
2.计算mRNA浓度:
备注:虽然大多数的配方推荐的N/P比为6,但是大量的实验表明,在后续的混合和超滤过程中,会损失20%左右的磷脂。所以在实践中我们推荐的N/P比为8。更高的N/P比可以降低超滤和透析引起的粒径变大,并提高mRNA的利用率。缺点是可能会增大对细胞的毒性,降低细胞的存活率。
根据N/P=8,FRR=3计算所需RNA浓度。
RNA的碱基的平均分子量为339.5,每个碱基携带1个磷酸,因此RNA中的含磷量为3.03 nmol/μg。
DNA的平均分子量按照318计算,DNA的含磷量为3.14 nmol/μg。
计算氮磷比时仅计算主要脂质中的氮原子数,因此每摩尔混合脂质中含有0.5摩尔N。

3.配制mRNA-柠檬酸缓冲液:
使用超纯水分别配制100 mM的一水合柠檬酸(分子量:210.14,称取1.05 g)和二水合柠檬酸钠(分子量:294.10,称取1.47 g)溶液各50 ml。
取33.0 ml柠檬酸溶液和17.0 ml柠檬酸钠溶液,混合后加入DEPC,静置30分钟后高压灭菌去除DEPC,灭菌后使用DEPC水定容至100 ml即得50 mM pH=4的柠檬酸缓冲液。
将mRNA测定浓度后根据脂质浓度使用柠檬酸缓冲液稀释至所需浓度。
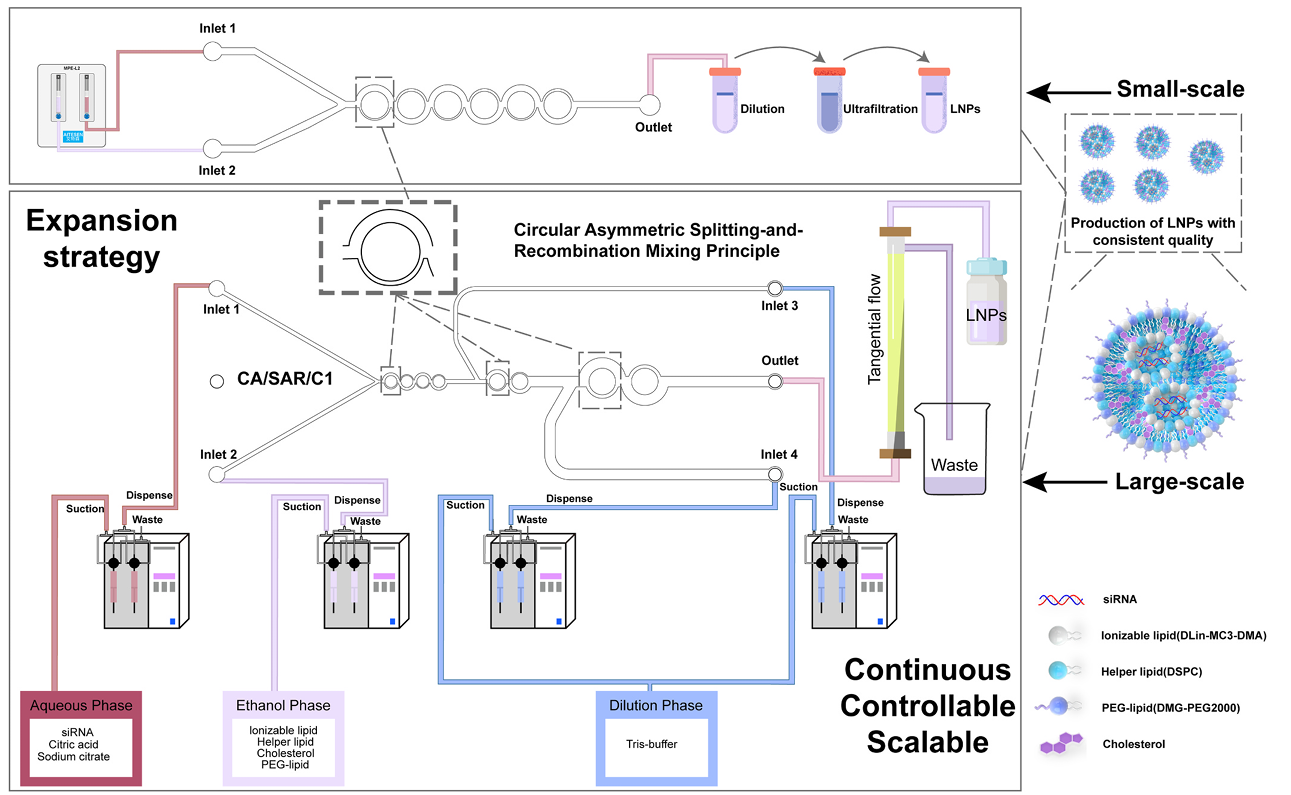
4.微流控混合:
一、装配微流控混合芯片和夹具:

如图1所示,将夹具翻转,右手拨开卡扣,打开夹具.

如图2所示,装入LNP混合芯片.
注意:芯片开口方向(logo正面)与夹具开口对准,芯片要完全陷入卡槽中。

如图3所示,合上卡扣,将夹具翻转至正面,芯片装载完成。

如图4所示,将夹具放置在托盘上,托盘下放置废液管和样品收集管。
将磷脂溶液和mRNA溶液导入,即可制作LNP。
二、预冲洗管路和微混合芯片:
预冲洗保证微混合芯片内部已经预先充满乙醇和柠檬酸缓冲液。
① 将无水乙醇和柠檬酸缓冲液通过0.22微米微孔滤膜过滤。
② 将无水乙醇吸入3 ml注射器中(吸入体积约0.7 ml),将柠檬酸缓冲液吸入3 ml注射器中(吸入体积约2.1 ml),并排出注射器中的空气。在注射器上标注“乙醇”和“缓冲液”。
③ 根据使用的注射器型号选择合适的注射器适配器(如本实验中选择使用BD 3ml注射器适配器),将注射器的适配器装载在设备卡槽中,抬起弹簧夹片,分别将“乙醇”和“缓冲液”注射器和样品导入管连接,并安装在LNP合成仪上,如下图所示。

④ 组装完成的LNP合成仪和芯片夹具如图所示:

⑤ 按照以下步骤选择合适的注射器型号、注射体积和流速。
(以LNP-B1为例,BD 3ml注射器,流速比1:3,总流速12 ml/min,产物总体积为4ml)。
a. 选择注射器设置:

b. 脂相(乙醇)设定:
c. 水相(缓冲液)设定:
⑥ 将废液管放置在夹具样品收集管下,收集流出的废液。
⑦ 点击开始,开始冲洗管路和芯片。
三、微流控混合制备LNP:
① 分别将分别将脂质-乙醇溶液和mRNA-柠檬酸缓冲液通过0.22微米滤膜过滤。
② 将脂质-乙醇溶液吸入3 ml注射器中(根据需要,至少需要吸入0.5 ml),将mRNA-柠檬酸缓冲液吸入3 ml注射器中(至少吸入1.5 ml),并排出注射器中的空气。
③ 将注射器出口和样品导入管连接,并固定在注射泵上。
④ 用户可根据具体需要来调整注射泵的流速和混合体积。推荐起始设定如下:
| 微混合芯片 | 脂质-乙醇相流速(mL/min) | 缓冲液相流速(mL/min) |
| LNP-B1 | 3 | 9 |
⑤ 点击运行,观察流出管流速稳定后(一般需要丢弃前100-200微升液体),用收集管收集流出的液体。一般在注射结束前1-2秒停止收集,丢弃最后1-2秒流出的液体(若配备自动切换前后废的装置,则需要在软件中设置)。
备注:也可以将流速设置为以下数据,无需丢弃前废液,收集所有的产物。
| 微混合芯片 | 脂质-乙醇相流速(mL/min) | 缓冲液相流速(mL/min) |
| LNP-B1 | 4.5 | 13.5 |
四、透析(或者超滤)与储存:
透析:
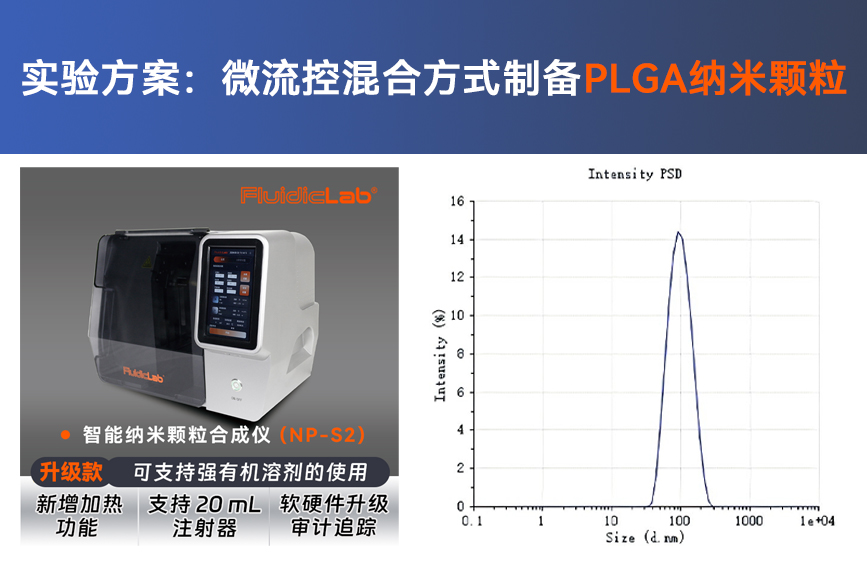
1、样品收集后,使用动态光散射仪测定LNP粒径和均一度。正常结果如下图所示:
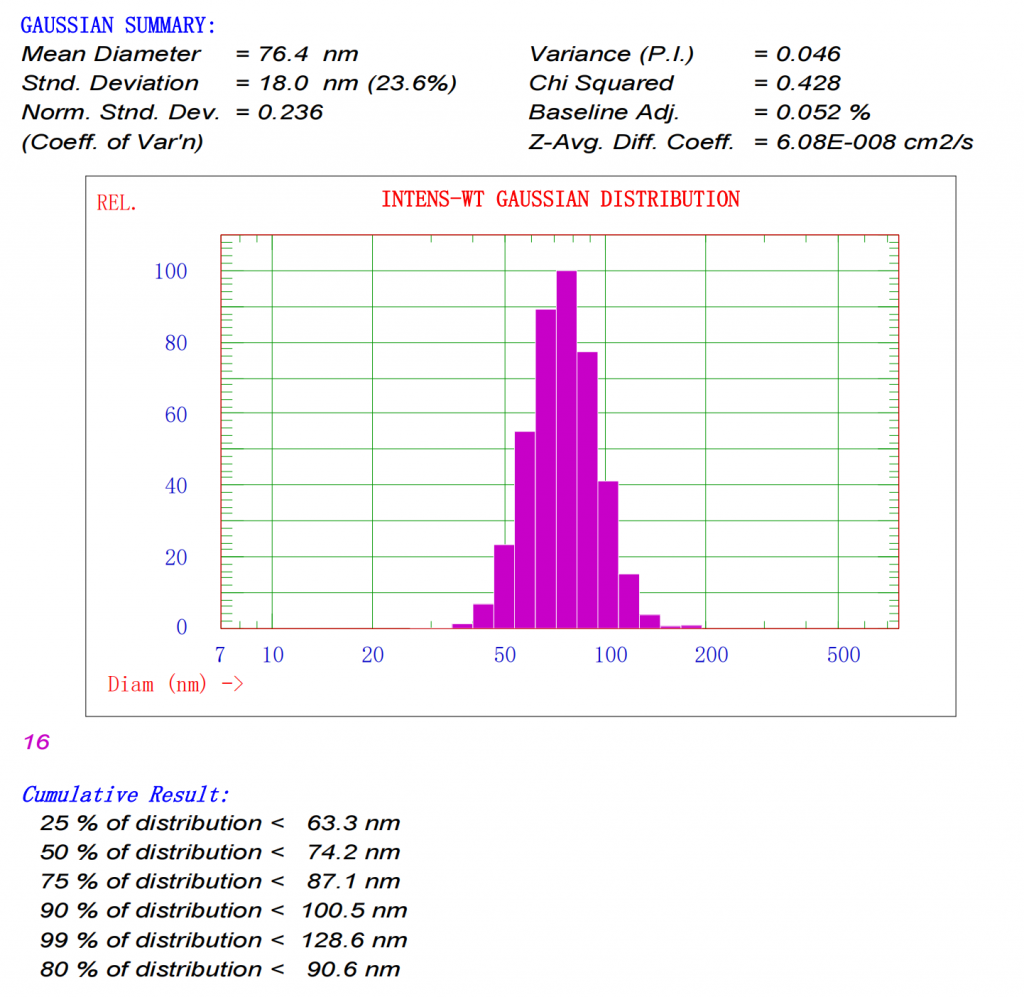
2、制备后放入透析管(Slide-A-Lyzer™ MINI Dialysis Device, 10K MWCO, 0.5 mL)中加入14 ml PBS在摇床上透析,每2小时后换液一次,重复操作直至18小时后透析结束。一般透析或者超滤后粒径和PDI均会略微增大。
3、终产物短期保存,可在含有 2%蔗糖的1x PBS中,4C保存。若需长期保存,则需置换为含有8%蔗糖的20mMTris-HCl中 (pH=7.4)。
超滤:
1、样品收集后,加入一倍体积的柠檬酸缓冲液/醋酸缓冲液稀释。
备注:不建议直接使用PBS或者Tris缓冲液稀释,过快改变LNP外环境pH会造成不可控的粒径增大。
2、使用Milipore 100 KD超滤管,3000 g离心超滤至原体积的1/4。
3、补加PBS/Tris缓冲液至原体积,再次超滤至原体积1/4。
4、重复步骤3两次,将乙醇含量降低至0.5%以下。
5、最后一次使用含有蔗糖保护液的缓冲液超滤浓缩。蔗糖终浓度达到8%。
6、将超滤后的液体收集,-80℃冻存。
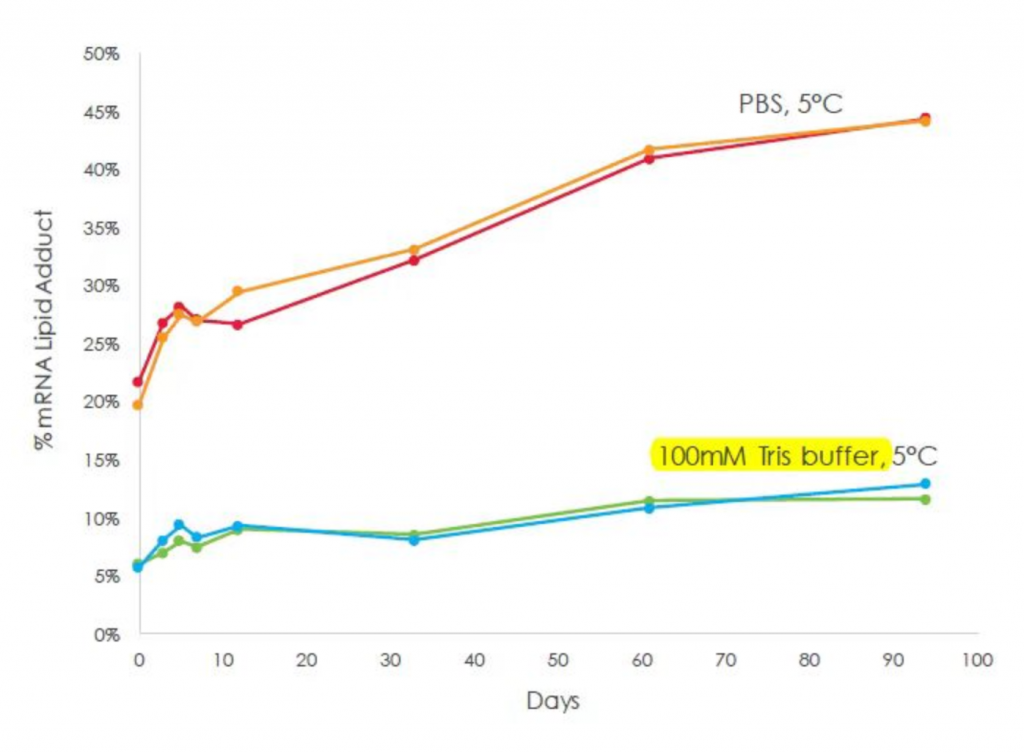
备注:根据moderna公开数据,SM-102更加适合使用Tris buffer进行保存。
实验名称:LNP包封率测定
实验目的:
对制备的LNP包封mRNA的效果进行测定。
实验原理:
Quant-iT™RiboGreen®RNA试剂是一种超灵敏的荧光核酸染色剂,可检测溶液中1-200 ng的核酸,这种核酸染料无法透过LNP,因此只有游离的未被LNP包载的核酸可以被结合。Triton-100作为一种表面活性剂常被用做破乳剂,使用1%的Triton-100处理获得的LNP-mRNA可以使包载的核酸释放,得到总核酸量。通过计算破乳前后核酸量的差异得到载药量,再除以总核酸量即可得到包封率,即:
包封率(%)=(破乳后定量-破乳前定量)/破乳后定量
实验材料:
Quant-iT™ RiboGreen™ RNA 检测试剂盒(Thermo Fisher,R11490)
Triton™ X-100 (SIGMA-ALDRICH,T8787-100ML)
DEPC水
CellCarrier-96 Ultra Microplates ( PerkinElmer,6055308)
实验步骤:
1.LNP制备
见LNP制备流程。
2.试剂准备(详细参见说明书):
将20xTE用DEPC水稀释至1x;
用稀释好的1XTE稀释试剂盒中的标准品,稀释成2 μg/mL及100 ng/mL两种终浓度;
用1xTE稀释试剂盒中的QuantiT™ RiboGreen® Reagen,稀释成200倍及2000倍两种终浓度;注意要同时制作含有/不含有Triton-X100的两套标曲;
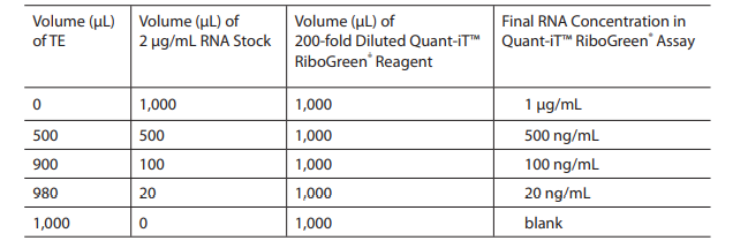
按照下表在CellCarrier-96 Ultra Microplates中加入以下试剂,做复孔:
High range
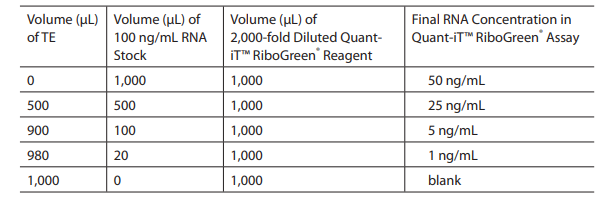
Low range
3.LNP破乳
将Triton-100用1xTE稀释到2%,取100 μl加入CellCarrier-96 Ultra Microplates,加入1 μl制备好的LNP,处理5分钟,加入100 μl 200-fold diluted quant-iT RiboGreen Reagent。
4.LNP游离核酸测定
在CellCarrier-96 Ultra Microplates中加入100ul1xTE,取1μl制备好的LNP加进去,混匀,加入100 μl l2000-fold diluted quant-iT RiboGreen Reagent。
5.读板
使用SPARK读取荧光强度,激发光设置为480 nm,发射光为520 nm
6.数据处理
1) 标曲制备
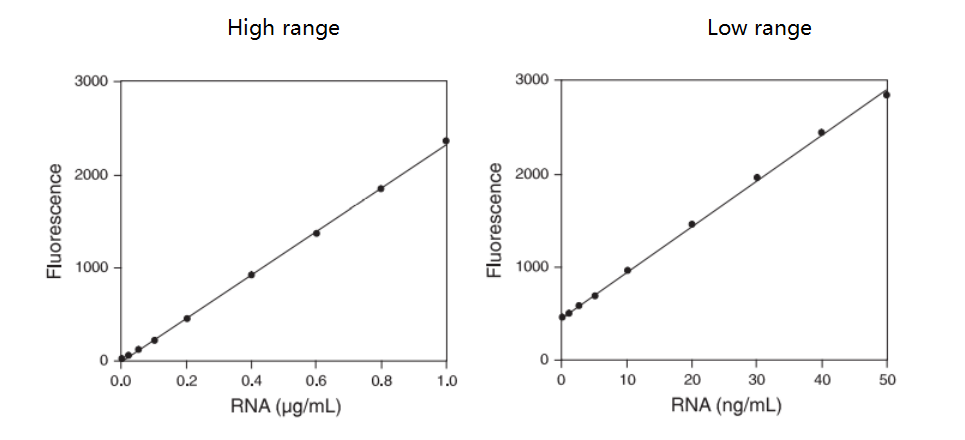
2) 样品定量
载药量=破乳后读值-破乳前读值
包封率(%)=载药量/破乳后读值
实验名称:使用LNP转染细胞
实验目的:
以293T细胞为例,使用包封了eGFP-mRNA的LNP对细胞进行转染。
实验步骤:
1、细胞准备:
铺板扩增细胞 (在24孔板中,按照细胞密度2.5×104 cell/ml,1ml/孔),孵育铺板过夜。
推荐一个制剂铺板18孔(6*3)。
2、细胞转染:
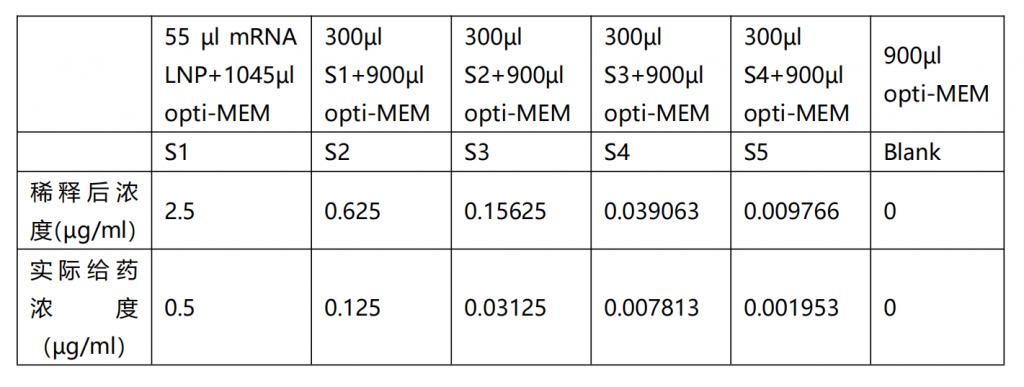
取出eGFP-mRNA LNP (50 µg/ml),用opti-MEM培养基稀释至2.5 µg/ml,
例如: 如果需要最终转染液1100 µl, 取55 µl mRNA LNP+ 1045µl opti-MEM),命名为S1,后取S1 300µl +900µl opti-MEM,得S2,倍比稀释,得S1-S5。
在每孔依次加入250µl LNP转染液,继续孵育4、6、8、12、24、48小时后,使用荧光显微镜观察绿色荧光表达。在48小时后,收集细胞,流式检测GFP信号阳性率。
一般4小时GFP渐渐有表达,8小时后可见明显绿色荧光。
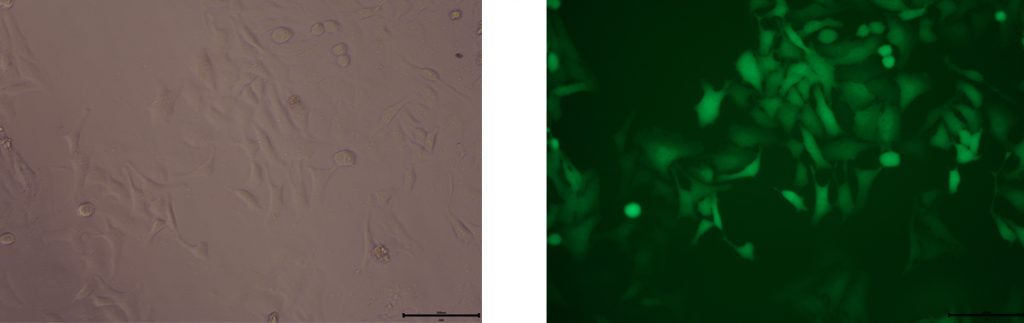
图5. 转染细胞后的表达效果图。左侧为明场照片,右侧为荧光照片。