近年来,空间转录组技术(Spatial Transcriptomics, ST)迅速发展,为探索细胞功能、调控机制及微环境互作提供了前所未有的空间视角。它被 Nature Methods 评为2020年度技术(Method of the Year 2020),并被誉为“将彻底改变细胞生物学、病理学及组织学的研究方式”。
空间转录组分类
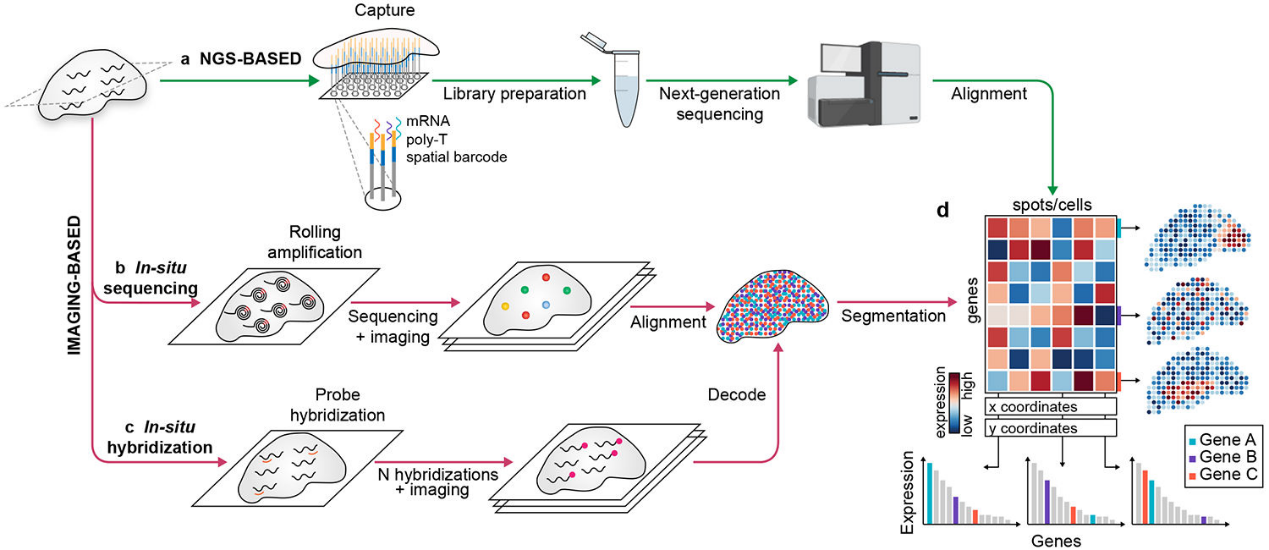
空间转录组结合高通量转录组测序与组织结构空间信息,弥补了传统单细胞RNA测序(scRNA-seq)在空间定位上的缺陷。ST技术主要分为两类:
- 测序型 ST(sST):通过空间条形码阵列捕获RNA,实现空间分辨测序(图1b);
- 成像型 ST(iST):基于荧光探针与循环成像,在单分子分辨率下实现靶基因的原位检测(图1c)。
其中,MERFISH(Multiplexed Error-Robust Fluorescence In Situ Hybridization)是具有代表性的突破性成像型ST技术。它融合smFISH与条形码编码原理,可在单细胞乃至亚细胞分辨率下,同时检测上千种RNA分子,精准定位其空间分布,极大推动了细胞微环境与组织结构的精细研究。
MERFISH 技术原理
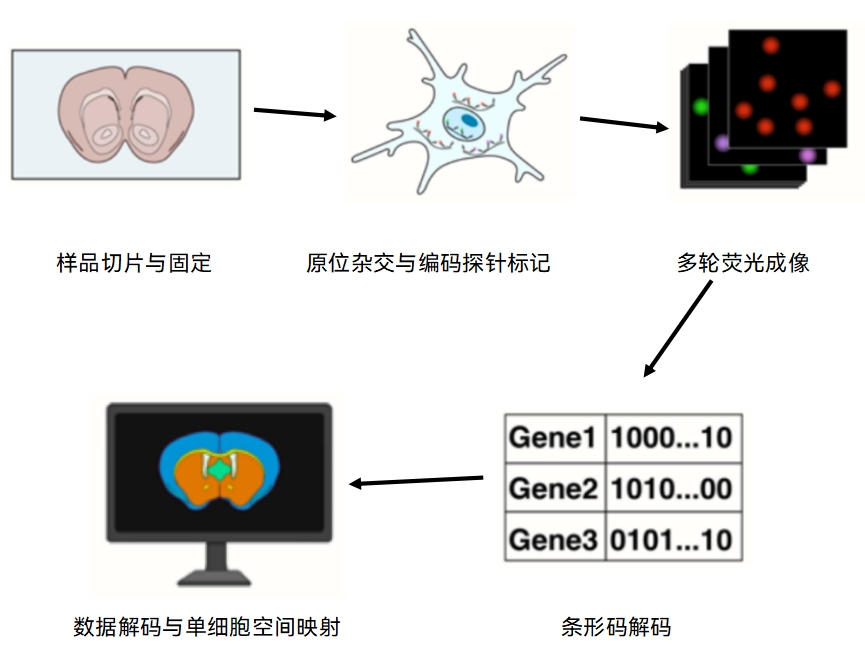
MERFISH通过组合编码和多轮荧光成像,实现了高通量空间转录组测量。其工作流程主要包括以下步骤[2]:
MERFISH 核心步骤:利用多轮荧光成像技术逐位读取RNA分子的条形码信息:第1轮使用识别第1位的荧光探针,RNA编码中第1位为“1”的分子发光;第2轮检测第2位为“1”的分子发光;依此类推,逐轮读取所有位点。每轮成像后,进行漂洗操作清除上一轮的荧光信号,确保每一轮成像结果独立准确。所有轮次成像结束后,计算机算法将每个RNA分子在不同轮次中的“亮/暗”模式还原为完整的二进制条形码,并与预设编码表进行比对,最终精确识别RNA的种类与空间分布。
多轮荧光成像读取RNA条形码信息后,经过条形码解码后,每个RNA分子不仅被准确识别其种类,同时还保留其在细胞内的精确空间坐标。结合细胞核和细胞膜的多通道荧光标记,通过图像分割算法可对组织切片进行细胞轮廓识别与分区,将每个RNA分子归属于特定单细胞。
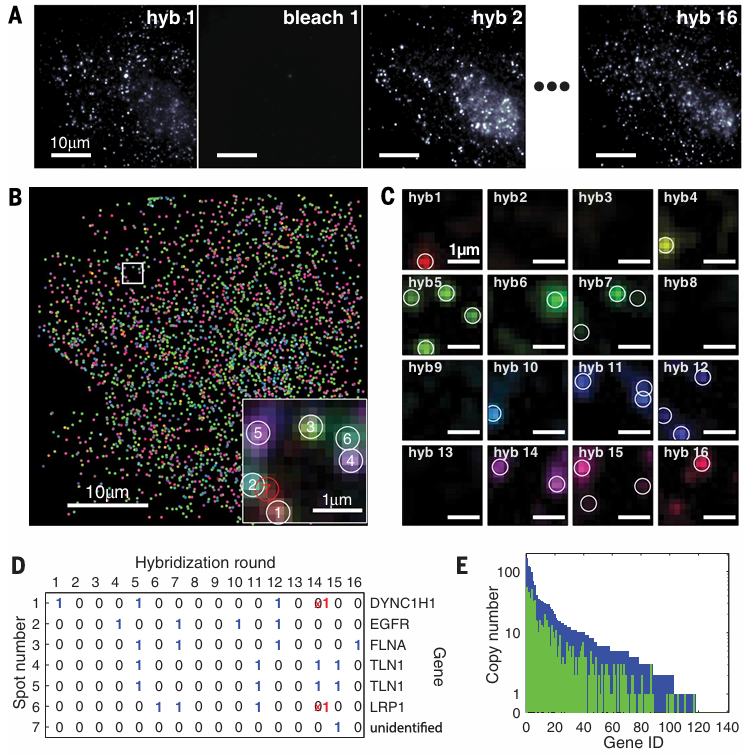 图3. 使用MERFISH 同时检测单个细胞中140 种 RNA[3]
图3. 使用MERFISH 同时检测单个细胞中140 种 RNA[3]
图 (A) 显示了多轮杂交荧光成像;图 (B) 将检测到的所有 RNA 以二进制编码方式着色标出;图 (C) 和 (D) 展示了选定区域在各轮成像时的荧光信号及对应的二进制编码;图 (E) 比较了纠错前后基因拷贝数的变化。
MERFISH 技术优势
MERFISH在以下方面具有显著优势:
- 高通量与高分辨率:单次实验可同时检测数百至上千种RNA分子,并精确定位至亚细胞水平,实现空间维度上的解析。
- 高灵敏度与定量准确性:具备卓越的检测灵敏度,低丰度RNA亦可可靠识别。独特的组合编码与纠错机制大幅降低成像误差,保障数据准确性。
- 丰富的空间信息:不仅获取RNA表达量,更能精准记录其在细胞内的空间位置,揭示细胞内结构分区及细胞间的微环境差异。
- 广泛适用性:适用于新鲜、固定及FFPE样本,广泛应用于肿瘤、神经、免疫、发育与微生物生态等研究领域,展现出强大的平台通用性与科研价值。
MERFISH 的最新应用进展
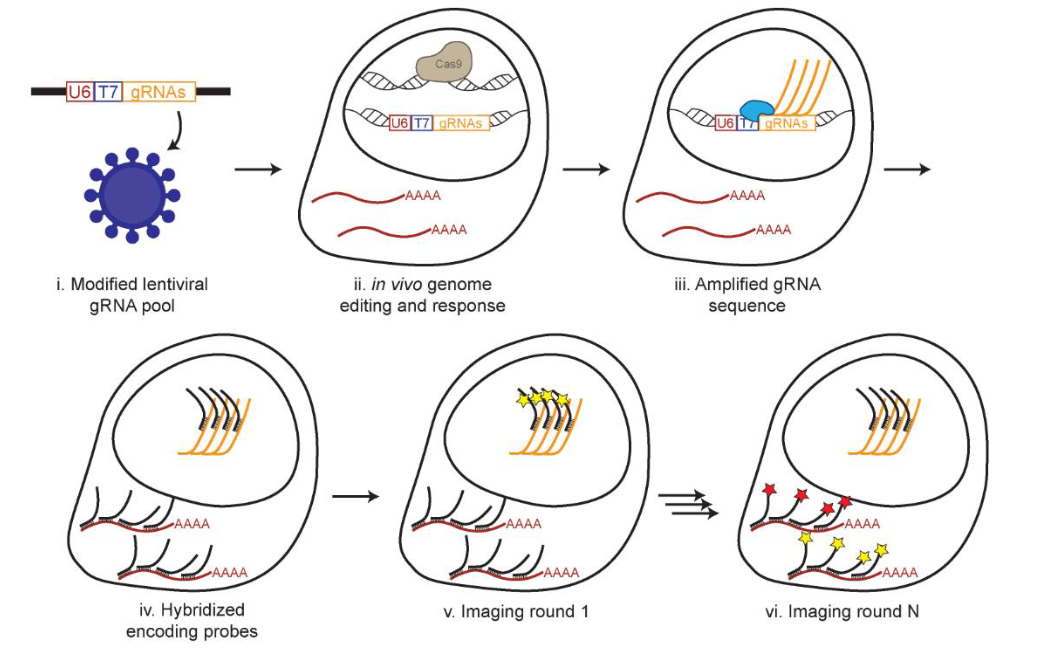
MERFISH可以与CRISPR筛选联合使用,解析细胞内转录程序和微环境对基因表达的影响。Binan 等(2025)[4]在《Cell》上发表的研究,通过该方法构建了细胞间及功能性转录调控网络,为基因功能研究和药物靶点发现提供新思路。
《Science》发表的研究《Highly Multiplexed Spatial Transcriptomics in Bacteria》[5]展示了MERFISH在细菌中的应用。Moffitt团队通过扩展显微镜优化MERFISH,实现了在单个细菌内同时检测数千个mRNA,并构建菌落的空间转录图谱,为肠道微生物和宿主—病原体相互作用研究提供了新工具。
图5. 细菌空间转录组学示意图
Fang 等(2022)[6] 利用MERFISH对人类中及小鼠皮层进行高通量单细胞转录组成像,成功构建了一个高分辨率、空间定位的细胞图谱。通过对4000个基因进行成像,研究者不仅实现了对125个转录上显著不同的细胞群的识别,还揭示了各细胞群在皮层各层的分布模式和细胞间相互作用。这张图直观展示了MERFISH如何在不破坏细胞空间结构的情况下,获取高维转录组数据,并为后续细胞类型分类、层状分布以及细胞间相互作用分析奠定基础。
FluidicLab-基于成像技术的核心模块-多液路进样系统
FluidicLab提供的全自动多液路进样系统,集成控、流体交换和时序控制模块,支持多轮探针(如初级探针、信号放大探针)的自动化孵育与洗脱。微流控芯片-流动腔内置预载核酸/抗体探针池,并通过特定读写的自动化程序控制系统运转,提升单分子检测精度。
图7. 多液路进样系统组成
应用方向:
结合多重核酸探针的merFISH技术;
结合多重蛋白抗体的空间蛋白组学技术等。
参考文献:
- Rao, A., Barkley, D., França, G. S. & Yanai, I. Exploring tissue architecture using spatial transcriptomics. Nature596, 211–220 (2021).
- Androvic, P. et al.Spatial Transcriptomics-correlated Electron Microscopy maps transcriptional and ultrastructural responses to brain injury. Nat. Commun.14, 4115 (2023).
- Chen, K. H., Boettiger, A. N., Moffitt, J. R., Wang, S. & Zhuang, X. RNA imaging. Spatially resolved, highly multiplexed RNA profiling in single cells. Science348, aaa6090 (2015).
- Binan, L. et al.Simultaneous CRISPR screening and spatial transcriptomics reveals intracellular, intercellular, and functional transcriptional circuits. BioRxiv Prepr. Serv. Biol.2023.11.30.569494 (2023) doi:10.1101/2023.11.30.569494.
- Sarfatis, A., Wang, Y., Twumasi-Ankrah, N. & Moffitt, J. R. Highly multiplexed spatial transcriptomics in bacteria. Science(2025) doi:10.1126/science.adr0932.
- Fang, R. et al.Conservation and divergence of cortical cell organization in human and mouse revealed by MERFISH. Science377, 56–62 (2022).