人类大脑极其复杂,因此开发任何中枢神经系统体外模型都是巨大的挑战。目前的动物模型缺乏许多基本的人类特征,传统的体外模型在模拟体内功能的能力也非常有限。这些模型的局限造成靶向中枢神经系统的药物开发成功率很低。过去的5年,中枢神经系统体外模型在复杂性和功能性方面都有了一个巨大的飞跃,新的模型有望克服传统模型的许多局限。hiPSC(人源诱导多能干细胞)技术的发展进一步提高了这些模型应用于转化医学的潜力。
但是,由于这些模型成本较高或成熟度较低,只有少数研究者采用了这些先进的体外平台。随着技术的发展,这些模型的制造成本已经大幅度降低,研究者也付出了巨大的努力来提高干细胞分化的质量。在此,我们将介绍2015年以来主要的中枢神经系统体外模型。我们特别关注细胞培养系统与微流控平台相结合的体外模型。我们将介绍这些系统的基本原理,回顾这些平台在健康和疾病研究中的成功实践。随后我们将总结这些模型在个性化医疗或大规模工业环境中应用所面临的挑战,并为正在考虑采用器官/类器官芯片技术的实验室提供了实用指南。
缩写:ALS=肌萎缩性侧索硬化症;BMEC=脑微血管内皮细胞;COVID-19=新型冠状病毒肺;ECM=细胞外基质;GBM=多形胶质母细胞瘤;hiPSC=人源诱导多能干细胞;NVU=神经血管单位;PDMS=聚二甲基硅氧烷;SARS-CoV-2=严重急性呼吸综合症冠状病毒2;TBI=创伤性脑损伤;TEER=跨内皮电阻
本文包括以下章节:
一. 中枢神经系统体外模型概述
二. 使用hiPSC构建中枢神经系统体外模型:优势和挑战
三. 类器官/器官芯片中枢神经系统体外模型介绍
四. 基于类器官/器官芯片的中枢神经系统疾病模型
五. 商品化的类器官和器官芯片系统使用指南
简介
人类大脑的复杂性远超其它动物。人类大脑体积大、皮层折叠程度高,人类神经疾病往往拥有独特的生理病理特征。不幸的是,目前应用于转化医学的中枢神经系统模型存在诸多缺陷:动物模型缺乏许多基本人类特征,价格昂贵,通量低,而且往往存在伦理问题;传统的体外模型不能提供行为反应、功能反应或系统反应(器官-器官相互作用)的信息,对许多实际应用来说显得过于简单。
缺乏合格的中枢神经系统体外模型是中枢神经系统药物开发成功率低的一个重要原因(Kesselheim et al., 2015; Gribkoff and Kaczmarek, 2017);较低的药物开发成功率又导致许多大型制药公司缩减了它们在神经系统领域的研发投入(Wegener and Rujescu, 2013)。
为了更好的模拟健康和病理条件下中枢神经系统的生理特征和功能,许多学术和产业研究人员开始使用iPSCs (Shi et al., 2017),器官/类器官芯片(Pasca, 2018),水凝胶3D打印(Hopkins et al., 2015)等技术来建立新的体外模型。虽然这些方法仍无法完全复现人类大脑复杂的生理学、解剖学特征和功能,但他们在模拟体内功能和发病机理,揭示现有体外模型无法发现的生理互作方面展示了光明前景。
为了让读者快速了解不同的中枢神经系统模型,我们比较了啮齿动物模型、传统细胞培养、类器官和器官芯片模型,对每个模型在中枢神经系统研究的可用性进行了评级(表1)。先进的体外模型在成本、易用性、可获得性等方面正变得平易近人。这些模型有助于补充传统的体外和体内模型,从而提高临床前评估的总体准确性。
在随后的综述中,我们将主要覆盖以下方面:
1、中枢神经系统体外模型的一些主要进展。
2、考虑到先进的体外平台的一个关键目标是提高实验结果的可转化性,我们重点讨论了将hiPSCs整合到这些平台的一些挑战。
3、详细解释了中枢神经系统体外模型的一些基本原理,并讨论了这些模型的一些成功实践。
4、中枢神经系统疾病模型。
5、为考虑采用这些技术的生物医学实验室提供了实用的指南。
章节一、中枢神经系统体外模型概述
一个合格的中枢神经系统体外模型必须满足两个条件:
1. 包含所有的功能细胞类型。中枢神经系统是一个复杂的细胞网络,由神经元、星形胶质细胞、少突胶质细胞、周细胞、免疫细胞和血管内皮细胞组成,并生长在组织特异性的细胞外微环境中 (Rauti et al., 2019)。了解中枢神经系统的机理对于识别潜在的药物靶点,预测药物副作用,了解神经系统疾病的发病机制至关重要。
2. 充分模拟细胞外环境。除了包含不同的细胞亚型,合格的中枢神经系统体外模型还必须重现细胞外环境,包括特殊的细胞组织形式和细胞间的相互联系。因此,在构建模型时,必须尽可能重新细胞外基质(ECM)的物理、化学和机械特性(Frantz et al., 2010; Abdeen et al., 2016; Uwamori et al., 2017)。
大脑ECM由三个基本的结构组成:基底膜、神经周网和间质基质(Novak and Kaye, 2000; Yamaguchi, 2000; Bonneh-Barkay and Wiley, 2009; Lau et al., 2013; Rauti et al., 2019)。基底膜主要由IV型胶原、层粘连蛋白-核原复合物、纤维连接蛋白、硫酸肝素蛋白聚糖(perlecan和agrin)和大量的生长因子组成(Baeten and Akassoglou, 2011;Xu et al., 2019;Barcelona and Saragovi, 2015)。神经元周网主要由透明质酸、蛋白聚糖组成。间质基质则由蛋白多糖、透明质酸、肌腱蛋白和纤维蛋白组成 (Novak and Kaye, 2000;Rauti et al., 2019)。大脑ECM外环境是细胞迁移的物理支持,也传递影响细胞生长和分化的机械和生化刺激 (Garcı´a-Parra et al., 2013;Levy et al., 2014;Potjewyd et al., 2018;Rauti et al., 2019)。
目前广泛使用的中枢神经系统体外模型包括二维和三维细胞培养模型 (Zhuang et al., 2018)。原代细胞或组织培养模型保留了大多数细胞原位特征,比较如实地反映细胞形态和功能信息(Balgude et al., 2001;Hopkins et al., 2013)。但是,它们仍存在长期保存后活性降低,传代能力的缺陷以及细胞成熟后多样性的问题( (Walsh et al., 2005;Gahwiler, 1981)。另外这些模型通常是动物来源的,因此缺乏人类大脑的复杂环路和结构(Herculano-Houzel, 2014; DeFelipe, 2015;Hopkins et al., 2015)。
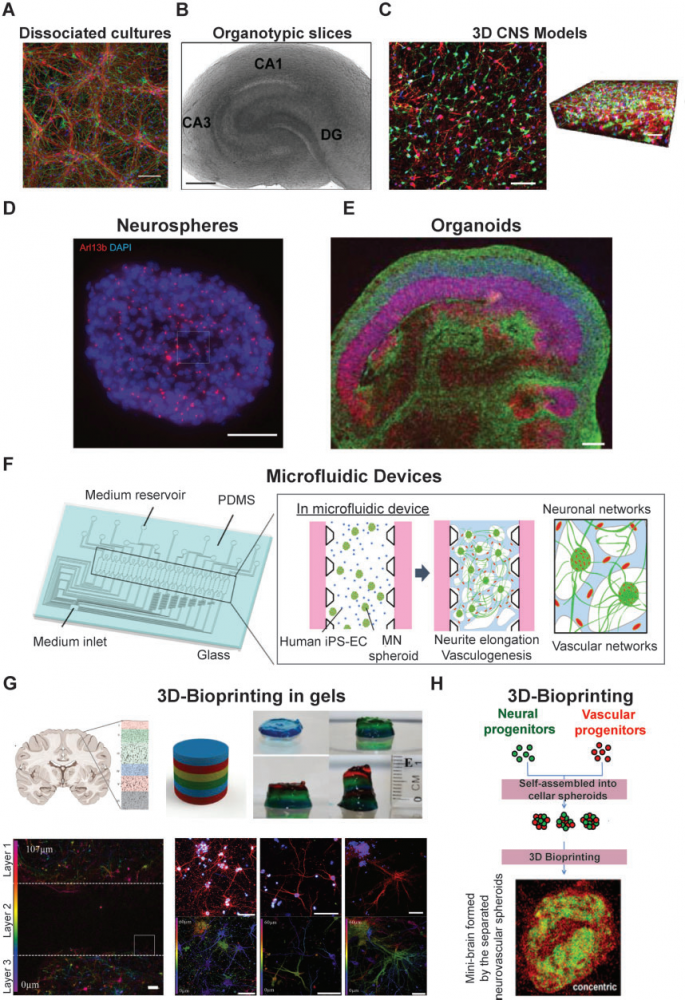
人类来源的干细胞和hiPSCs为开发可规模化复制的人类中枢神经系统模型创造了机会 (Dubois-Dauphin et al., 2010;Hopkins et al., 2015;Pacitti et al., 2019;Silva and Haggarty, 2020)。此外,3D体外培养系统(图1 C)可以再现复杂的细胞间相互作用,更加逼真的重现体内细胞微环境。新的3D中枢神经系统模型,如神经球和类器官(Hogberg et al., 2013),主要以干细胞技术为基础开发。神经球(图1 D)是自组装的致密结构,主要由神经干细胞、神经元和胶质限制性祖细胞、有丝分裂后的神经元细胞和死亡(濒亡)的细胞组成。神经球是研究神经发生和神经发育的有价值的系统,也是一个近乎无限的神经元和祖细胞的来源。神经球的一个主要问题是:由于对氧气和营养物质的获取能力有限,生长在神经球中心的细胞会死亡 (Bez et al., 2003;Jensen and Parmar, 2006)。其它缺点包括:神经细胞经过几轮传代后会丧失干细胞潜能,不同实验室之间培养的神经球实验结果重复性较差。
Lancaster and Knoblich (2014)首次引入了人类大脑类器官的概念(图1 E)。人类大脑类器官是一种来源于多能干细胞的自组装细胞群,具有早期胚胎中枢神经系统的谱系和结构。大脑类器官的使用已经呈指数级增长(Lancaster et al., 2013;Mariani et al., 2015;Jo et al., 2016;Raja et al., 2016;Lee et al., 2017)。鉴于类器官可使用基因组编辑技术,因此它对识别和测试新的治疗方法特别有用 (Yin et al., 2016;Gonzalez-Cordero et al., 2018;Pellegrini et al. 2020)。最近发表了一些体外类器官模型,展示了人类脉络膜丛的关键功能,屏障形成和脑脊液分泌,均展示了类器官模型的巨大潜力。类器官的缺点包括:它们自发形成的特性使得类器官在细胞类型和组织方面的可重复性较差。类器官也缺乏许多对器官生理功能至关重要特征,如血管灌注、机械刺激和循环免疫细胞的存在等(Ingber,2016)。
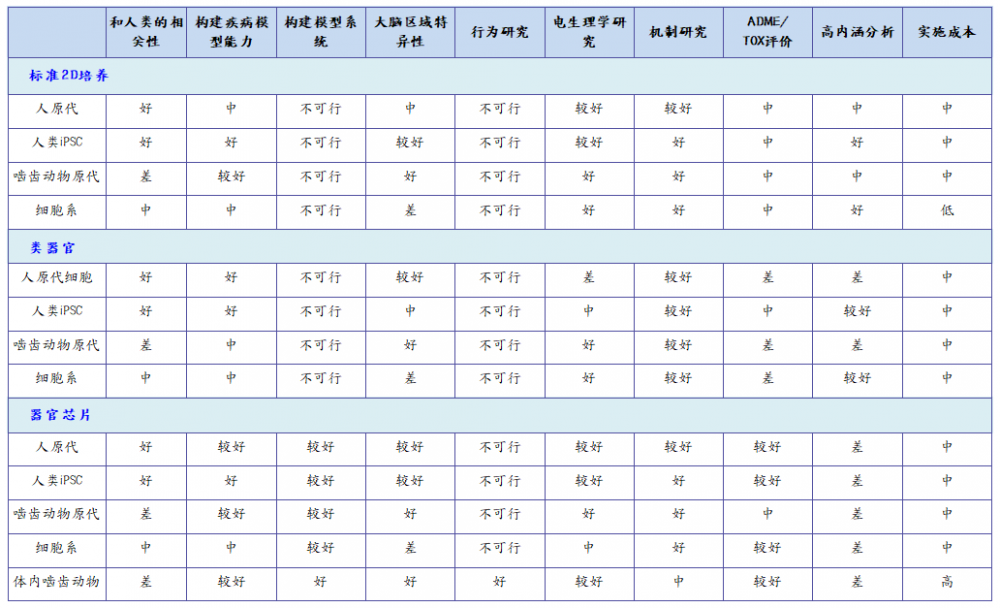
结合当前体外和体内模型的优势【表1】,科研工作者开发了器官芯片平台。在器官芯片中,细胞和组织在微腔室中培养,整体的微环境也可以得到很好的控制(Meyvantsson and Beebe, 2008;Meer and Berg, 2012;Halldorsson et al., 2015;MacKerron et al., 2017;Osaki et al., 2018;Sosa-Herna´ndez et al., 2018;Oddo et al., 2019)。最简单的器官芯片平台是一个单一的、可灌流的微腔,在其中可以生长一种细胞或多种细胞混合物。在更复杂的设计中,同一芯片中的两个或多个腔室被膜、通道或凝胶分开,以培养不同的细胞类型,各腔室的细胞直接接触或通过分泌物来传递细胞间的相互作用(图 1F和图 2)。在更高的层次上,通过连接两个或两个以上的器官芯片(图 1F),即可模拟不同的组织或区域的相互作用,实现更加复杂的功能(如血脑屏障) (Bhatia and Ingber, 2014;Phan et al., 2017;Oddo et al., 2019)。这些多芯片系统让研究多器官生理系统成为可能(Esch et al., 2014;Maschmeyer et al., 2015;Ingber, 2016)。
器官芯片有几个关键的优势:
1. 器官芯片设计灵活,制造成本低。
2. 与传统的细胞培养形式相比,污染风险低,试剂消耗少,实验通量高(Halldorsson et al., 2015)。
3. 血液流动和剪切应力可以得以模拟 (Bhatia and Ingber, 2014;Bischel et al., 2015;Benam et al., 2016;Ingber, 2016)。
然而,也有一些障碍限制了器官芯片的使用,这些障碍包括相当长的原型设计时间,缺乏标准化的实验步骤,需要专门的设备和复杂耗时的制造过程 (Coluccio et al., 2019)。
为了克服这些问题,研究人员一直在开发基于3D打印的(【图2】 G和H )的体外脑模型 (Lozano et al., 2015;Han and Hsu, 2017;Hampson et al., 2018;Sivandzade and Cucullo, 2018)。3D打印可以使用不同的材料(包括活细胞)沿着中枢神经系统的z轴来制作具有生物活性的3D结构,从而构建中枢神经系统体外模型 (Xu et al.,2006; Gu et al., 2016, 2018;Bishop et al., 2017;Han and Hsu, 2017;Thomas and Willerth, 2017;Knowlton et al., 2018;Potjewyd et al., 2018;Oliveira et al., 2019)。3D打印的体外模型可定制设计,精确制造更可靠的体内神经组织,以保证在临床研究和药物筛选过程中的一致性。但是,在3D打印中,需要开发出对细胞刺激最小的3D打印方法、保证模型可重复性、更好地复现体内神经组织中的分子梯度,设计细胞外基质、并对模型进行充分的验证 (Rauti et al., 2019)。
目前大多数器官芯片都相对较薄(100-1000 微米高,在这些结构中的细胞层更薄)。因此,与传统的3D培养不同,这些器官芯片通常与实时成像设备兼容,可用来做细胞迁移分析和传统的免疫组化评估。例如,Deosarkar 等使用共聚焦显微镜对器官芯片中的独立血管通道进行成像,成像尺寸为200*100*2762微米(Deosarkar et al,, 2015)。双光子显微镜最新技术发展,人工智能和机器学习辅助的先进3D成像技术 (Joshi et al., 2018;Masullo et al., 2018;Puls et al., 2018; Scheeder et al., 2018;Booij et al., 2019)和生物传感器的集成(Misun et al., 2016;Maoz et al., 2017),hiPSC衍生的细胞援建有望推动3D体外建模的进展。最近评估表明,生物传感器、微流控技术和组织培养的结合可能很快就会大幅度减少基于动物模型的研究(Dove et al., 2018)。
除了基于细胞的体外平台的外,基于纯理化和计算的体外模型的发展也很重要,部分可以作为基于细胞的模型的替代品。这类模型包括固定化人工膜测量(IAM)、平行人工膜渗透性测量(PAMPA)和固体支持磷脂膜测量(TRANSIL)(Vastag and Keseru, 2009;Sharma et al., 2019)。基于计算模型和模拟,如机器学习和深度学习方法也正在变得越来越复杂(Yuan et al., 2018),可以用来补充甚至替代一些生物学实验。基于计算的模型提供了合成、预筛选和虚拟测试新药物的可能性,降低了实验室实验和昂贵的临床试验的需要,加速了药物开发过程 (Naik and Cucullo, 2012;Alsarrani and Kaplita, 2019;Chlebek et al., 2019)。然而,这些基于非细胞的模型验证还不够充分,通过这类研究获得的结果必须通过体外和体内研究来验证 (Naik and Cucullo, 2012)。
事实上,确保一个模型忠实地再现了体内的生理、病理过程,对于任何模型在转化医学中应用都是必不可少的。由于中枢神经系统生物学上的复杂性,验证体外中枢神经系统模型格外具有挑战性。因此,需要巨大的努力来确定中枢神经系统体外模型能在多大程度上代表体内的反应。例如,Belle等最近使用电生理方法来对比体内和体外培养的皮层神经元之间的差异。对于任何模型来说,体外到体内的比较都至关重要 (Frazier, 1990;Belle et al., 2018;Jones et al., 2018)。
另一个阻碍中枢神经系统体外模型应用于转化医学的障碍与它们所使用的细胞有关。例如,虽然器官芯片的主要目的是模拟人体内的微系统,但本文中引用的许多器官芯片研究都使用动物细胞,而不是来自hiPSC的细胞(表1)。尽管我们相信基于hiPSC的器官芯片有很大的希望应用于未来的精准医疗,但即使是基于hiPSC的系统也不可能完全预测体内的结果(Doss and Sachinidis, 2019;Ortuno-Costela et al., 2019)。由于科学家们在体外体系中使用hiPSCs仍然面临的巨大困难,因此目前的体外模型还依赖于非hiPSC来源的细胞,大大限制了其在转化医学中的指导作用。
未完待续,敬请关注!