聚乳酸-羟基乙酸共聚物(PLGA)因其独特的生物相容性、低免疫原性以及生物降解性,已被美国食品与药品管理局(FDA)批准用于药物辅料而进入药典。PLGA在人体内经过降解,生成乳酸与羟基乙酸,两者均是人体代谢的副产物,不具有毒性。
PLGA纳米颗粒的用途十分广泛。目前已有报道运用PLGA纳米颗粒包封一些治疗癌症的药物,如:阿霉素(DOX)、紫杉醇(PTX)、白藜芦醇等。与游离的药物相比,PLGA纳米颗粒包封的药物对肿瘤的治疗效果有所提升。此外,PLGA纳米颗粒还可以用于包裹蛋白质、多肽与DNA等生物大分子,以制备化妆品、骨修复材料等多类产品。同时,由于PLGA的机械强度大,其对包裹的内容物具有很好的保护作用。合适的制备工艺可以增加内容物的溶解性,提高其生物利用度,也可作为药剂缓释的载体。因此PLGA纳米颗粒具有广泛的开发前景。
| 温馨提示:由于实验方案在不断优化更新,以下实验方案内容仅供参考,如有需要,请通过网站上的联系方式向工作人员获取实时更新的版本PDF文件。(FluidicLab编辑并发布,转载请通知我们)。 |
实验目的及方法:
使用微流控方式,制备PLGA纳米颗粒
实验原理:
使用微流控进行PLGA纳米颗粒的合成,原理上分为两种。第一类称为“自上而下”的合成(Top-down,图1)。该类合成使用难溶于水的溶剂(如二氯甲烷,即DCM)溶解PLGA。当[PLGA-二氯甲烷]与[PVA-水]溶液接触时,两者混合发生乳化,形成较大的PLGA颗粒。初始产物的乳化液通过微混合器芯片的连续混合,分解成细乳化液。同时,有机溶剂扩散到周围的水相中(室温下二氯甲烷在水中的溶解度为2%),颗粒固化,直径进一步减小。
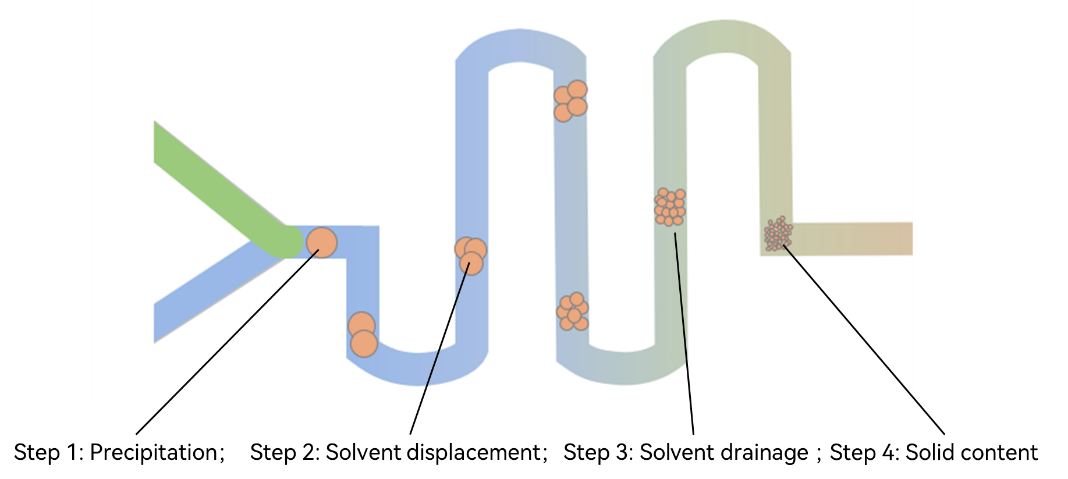
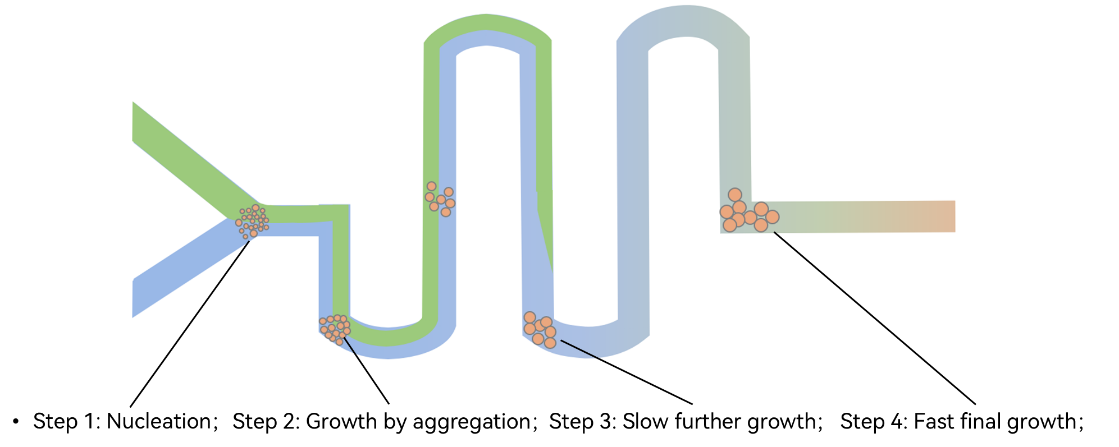
另一种称为“自下而上”的合成(Bottom-up,图2)。该类合成使用易溶于水的溶剂(如丙酮)溶解PLGA。在[PLGA-丙酮]与[PVA-水]溶液混合之时,PLGA自发、随机地析出形成微核。随着层流混合的加剧和丙酮浓度的持续下降,微核表面会持续析出PLGA,并逐步变大。该过程称为PLGA纳米颗粒的“生长”(Particle growth)。该过程会持续于整个微流控混合的过程中。而高效、均匀的混合可以确保该过程的持续性、稳定性和均一性,产生高单分散性的PLGA纳米颗粒。在该过程中以及合成完毕后,PLGA纳米颗粒会逐步硬化并形成最终产物。
实验材料:
| 试剂 | 脂质成分(溶于丙酮) | PLGA(LA:GA=50:50, 20 kDa) |
| 缓冲液成分(溶于超纯水) | 聚乙烯醇(PVA,30000-70000) | |
| 溶剂 | 丙酮 | |
| 超纯水 | ||
| 耗材 | 合成需要 | BD/新华/KDL 带鲁尔口的注射器若干 |
| Falcon 15 mL离心管(352096) | ||
| 20 mL棕色玻璃瓶若干 | ||
| 若透析 | 生工透析膜,生物技术等级,CE膜,100 KD,扁平宽度24 mm,容积1.8 mL/cm (F131417-0001) | |
| 若超滤浓缩 | 15 mL/100kD Milipore超滤管(外径50 mL) | |
| 微混合芯片 | FluidicLab 金属-玻璃芯片:MTGL-FL-001 | |
| 设备 | 微流控PLGA合成 | FluidicLab 智能纳米颗粒合成仪(NP-S2) |
| PLGA检测 | 动态光散射仪(本文中使用Malvern ZS90) | |
| PLGA超滤 | 冷冻离心机 | |
| PLGA冷冻干燥 | 冷冻干燥机 |
微流控法制备PLGA纳米颗粒的难点
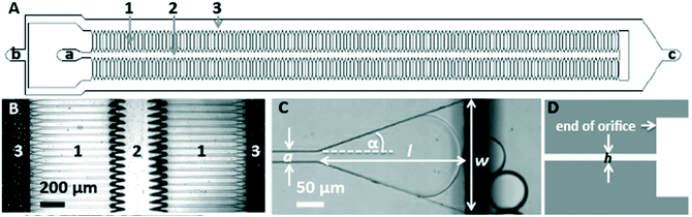
溶解PLGA一般需要强有机溶剂进行,包括二氯甲烷、丙酮等。而这些强有机溶剂经测试,短时接触即会对常用芯片材质COC(或各类聚合物)造成不可逆损伤(图3. A)。内部混合结构会逐步被破坏,导致混合效果变差。若使用玻璃芯片,则存在价格高、需要专用注射器接头进行转接等问题。FluidicLab智能纳米颗粒合成仪(NP-S2),配合独创专利“金属-玻璃”芯片助力PLGA纳米颗粒的合成(图3. B)。

图3. A:丙酮对我司B1芯片(COC材质)的腐蚀测试。左侧鲁尔口注入丙酮,右侧未处理。芯片表面涂抹一定量的丙酮;B:丙酮处理后B1芯片内部鱼骨结构,箭头处可见裂纹;C:金属玻璃芯片实物图;图片由具有丙酮购买、使用资质的客户提供。
用于微纳颗粒合成的金属-玻璃芯片

该芯片与纳米颗粒合成仪NP-S2机型适配。适合于中等体积 (总合成体积0.4~40 mL)、中等流速 (总流速4~40 mL/min)下的各类纳米颗粒合成。
实验步骤:
1.配置PLGA溶液
配置浓度为100 mg/mL的PLGA母液。
称取PLGA 1 g,加入10 mL丙酮。若溶解困难,可使用超声辅助溶解。使用0.22 μm的PTFE滤膜过滤,确保终产物中不含微小的固态颗粒。根据合成的PLGA粒径需要,可将PLGA稀释至不同的浓度。
使用微流控合成PLGA纳米颗粒时,PLGA纳米颗粒粒径与PLGA初始浓度相关联。当PLGA溶于丙酮溶液时,10 mg/mL PLGA可以获得该配方下粒径最小、最均一的PLGA纳米颗粒;其浓度对其合成后的粒径影响可分别参考附录-附件1。
2.配置PVA溶液
配置浓度为2%(w/v)的PVA溶液。
称取0.2 g PVA粉末,加入6 mL超纯水震荡,放入85℃水浴锅中搅拌、加热直至溶解。溶解后使用超纯水定容至10 mL。使用0.22 μm滤膜过滤,确保终产物中不含微小的固态颗粒。若需大量合成,则等比例放大配置量。
3.微流控合成(见智能纳米颗粒合成仪NP-S2操作说明)

在制备纳米颗粒(如LNP、Liposome)的过程中,关键步骤是有机相与缓冲液在微流控芯片中高速均匀的混合。通过先进的微流控技术,智能纳米颗粒合成仪(NP-S2)能够制备粒径高度均一且可控的纳米颗粒。经验证,S2同时具备了高重复性、低样本消耗、易于操作等优势,大幅提高了客户前期配方筛选的效率。
当使用丙酮作为PLGA溶剂时,微流控合成中的实验参数推荐值如下:
总流速 12mL/min、流速比为1:1、以获得粒径最小且最均匀的PLGA。实验者也可以根据实验需求调节流速比、总流速等参数来获得更大粒径的PLGA纳米颗粒。本方案是PLGA空包的实验流程,根据文献报道及实验测试,一般包裹了药物后PLGA纳米颗粒的粒径会变大。变大程度与药物的种类、浓度相关。关于微流控参数对空包PLGA合成的影响见附录-附件2 ~ 3。
4.粒径和PDI的检测
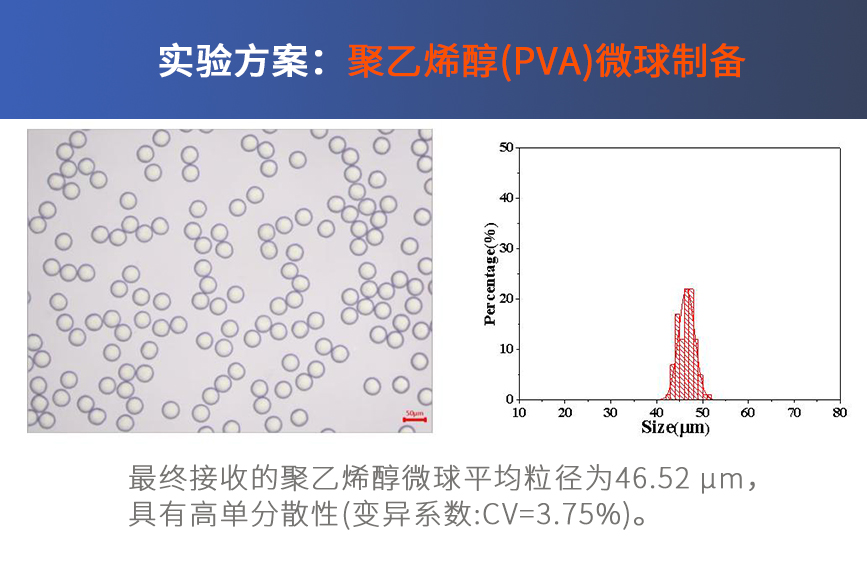
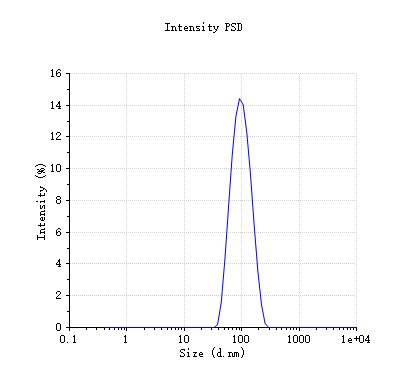
由于合成的PLGA纳米颗粒中含有丙酮与PVA,过高的浓度会影响动态光散射仪(DLS)测量的准确性。我们根据测试(附录-附件4)推荐使用超纯水进行10倍稀释(产物 : 水 = 1 : 9),从而获得较为准确、可信而稳定的数据。DLS会测定粒径大小与多分散性指数(PDI),前者代表了纳米颗粒的大小,后者则反应了颗粒的均一程度。正常结果如图4所示:
5.PLGA后处理
A.透析
不同厂家的透析膜有不同的预清洗/预处理流程,请严格参考各厂家透析膜使用说明。本文以生工CE透析膜(F131417-0001)为例进行说明。
预处理时,在室温下,剪取所需长度的膜,将膜浸泡在蒸馏水中15~30分钟除去防腐剂,然后用去离子水彻底冲洗膜。该款膜为防腐剂湿型包装,建议佩戴口罩、手套等防护用品操作。不推荐煮沸处理,以免损坏膜管或膜孔径。
注意:膜一旦处理为潮湿状态,不可让膜变回干燥状态,以免造成孔隙结构损坏。
由于我们使用的PVA分子量在30 K-70 K之间,故不建议使用100 kD以下孔径的透析袋或膜,过小孔径的膜会导致PVA被截留在袋内。
用透析膜夹,密封夹住透析膜一端;将合成后的PLGA纳米颗粒初产物液体直接移入透析袋,尽可能排空气泡。随后用透析膜夹封住另一端。为确保密封,可将冗余部分透析袋翻折后再夹紧。将该装有PLGA纳米颗粒初产物的透析袋置于至少100倍体积的超纯水中,室温透析至少6h,或透析过夜。在透析2h后,中途进行1~2次换液。
B. 超滤
若不进行透析,初产物PLGA也可使用超纯水补足到15 mL,加入100kD超滤管中。于4 ℃,4000 g;离心45分钟。如此反复进行三次超滤。
对于PLGA纳米颗粒,我们更推荐超滤的方式进行后处理。此步骤有别于LNP合成。
超滤或透析后,每1mg PLGA产物加入1mg海藻糖/蔗糖进行保存,短期可保存于4℃,长期保存则需进行冷冻干燥。
6.PLGA的冷冻干燥
冷冻干燥后,PLGA可以重新溶解于水相。根据我们的实验结果可知,无保护剂情况下重新溶解的PLGA纳米颗粒粒径与PDI都与原始颗粒相比,显著增大;而加入蔗糖或海藻糖作为保护剂后,能够有效稳定PLGA纳米颗粒。冷冻干燥步骤如下:
- 首先将样本置于培养皿中,增大表面积,-80℃冰箱进行预冷冻;
- 设置样本进行-50℃,常压下的冷冻干燥;持续3小时
- 设置样本进行-50℃,抽真空后进行冷冻干燥;持续15小时。
说明:本文所有实验或测试结果均来源于有丙酮购买和使用资质的实验室合作得出。
附录
附件1:不同浓度的PLGA-丙酮与合成的PLGA纳米颗粒粒径\PDI的关系
附件2:PLGA纳米颗粒合成的总流速与粒径\PDI的关系(PLGA-丙酮)
附件3:PLGA纳米颗粒合成的流速比与粒径\PDI的关系(PLGA-丙酮)
附件4:不同稀释方法与PLGA纳米颗粒粒径\PDI的关系
附件1:不同浓度的PLGA-丙酮与合成的PLGA纳米颗粒粒径\PDI的关系
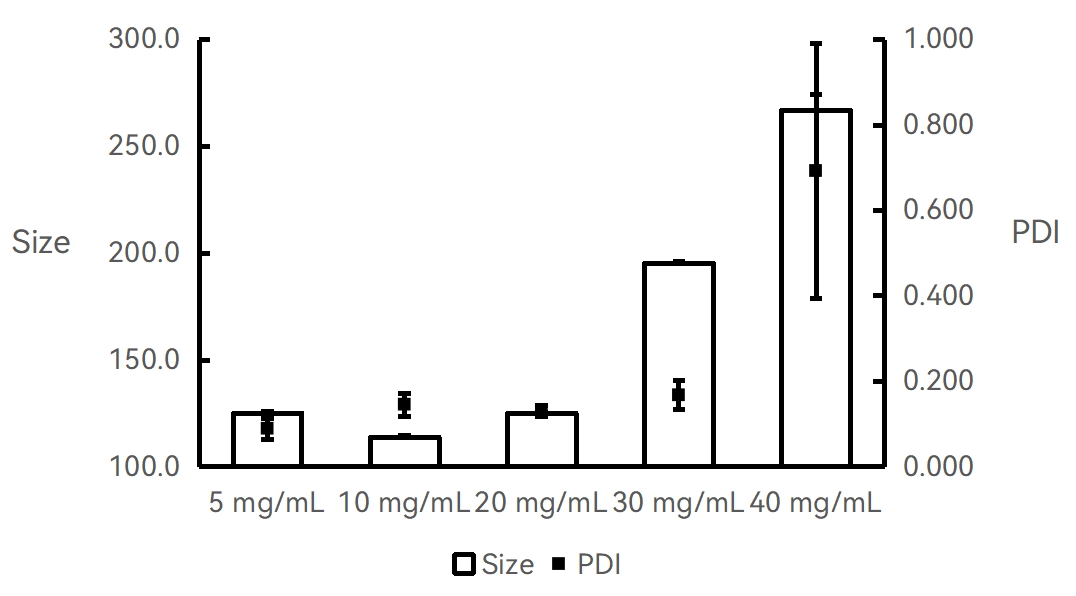
实验条件:仪器:Fluidiclab-NP-S2;芯片:Fluidiclab-MTGL-FL-001
不同浓度的PLGA-丙酮溶液;总流速:12 mL/min;流速比(脂相:水相=1:1);前废液:0.5 mL;超纯水稀释至10倍检测。
【结论】该实验条件下,10 mg/mL的PLGA-丙酮溶液可得粒径最小的PLGA纳米颗粒。
附件2:PLGA纳米颗粒合成的总流速与粒径\PDI的关系(PLGA-丙酮)
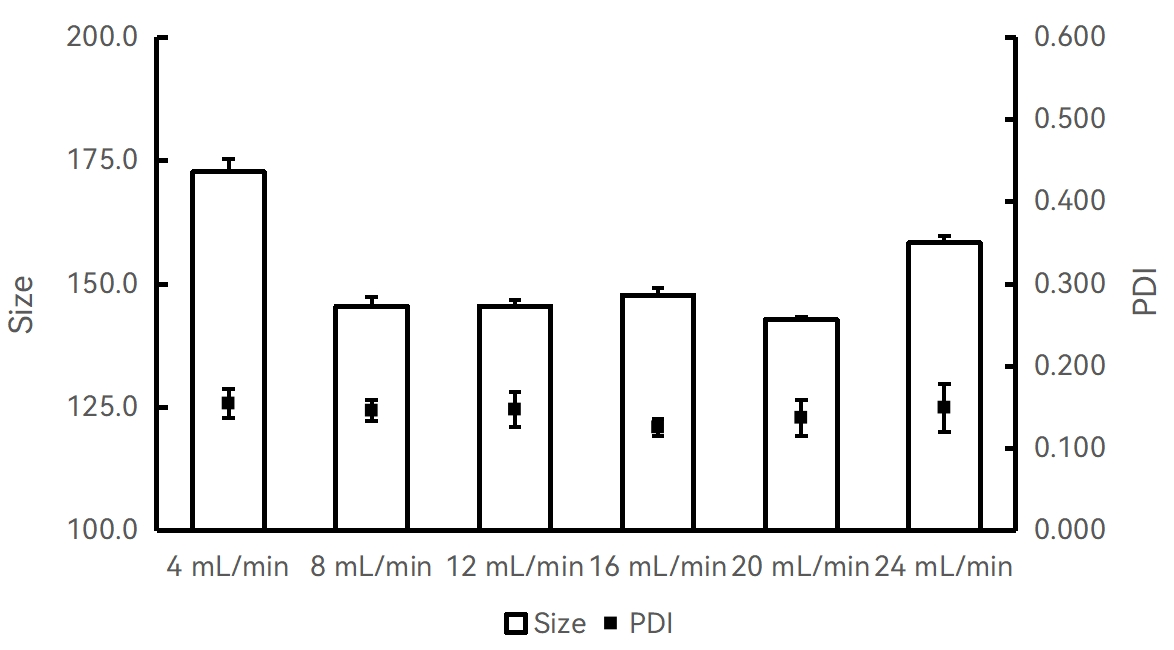
实验条件:仪器:Fluidiclab-NP-S2;芯片:Fluidiclab-MTGL-FL-001
20 mg/mL PLGA-丙酮溶液;流速比(脂相:水相=1:1);不同总流速与粒径的关联;前废液:0.5 mL;使用超纯水稀释至10倍后检测。
【结论】该实验条件及PLGA配方下,使用8mL/min的总流速即可获得较小粒径的PLGA纳米颗粒,且增加流速粒径变化不显著。20mL/min流速得到的PLGA纳米颗粒粒径最小。
附件3:PLGA纳米颗粒合成的流速比与粒径\PDI的关系(PLGA-丙酮)
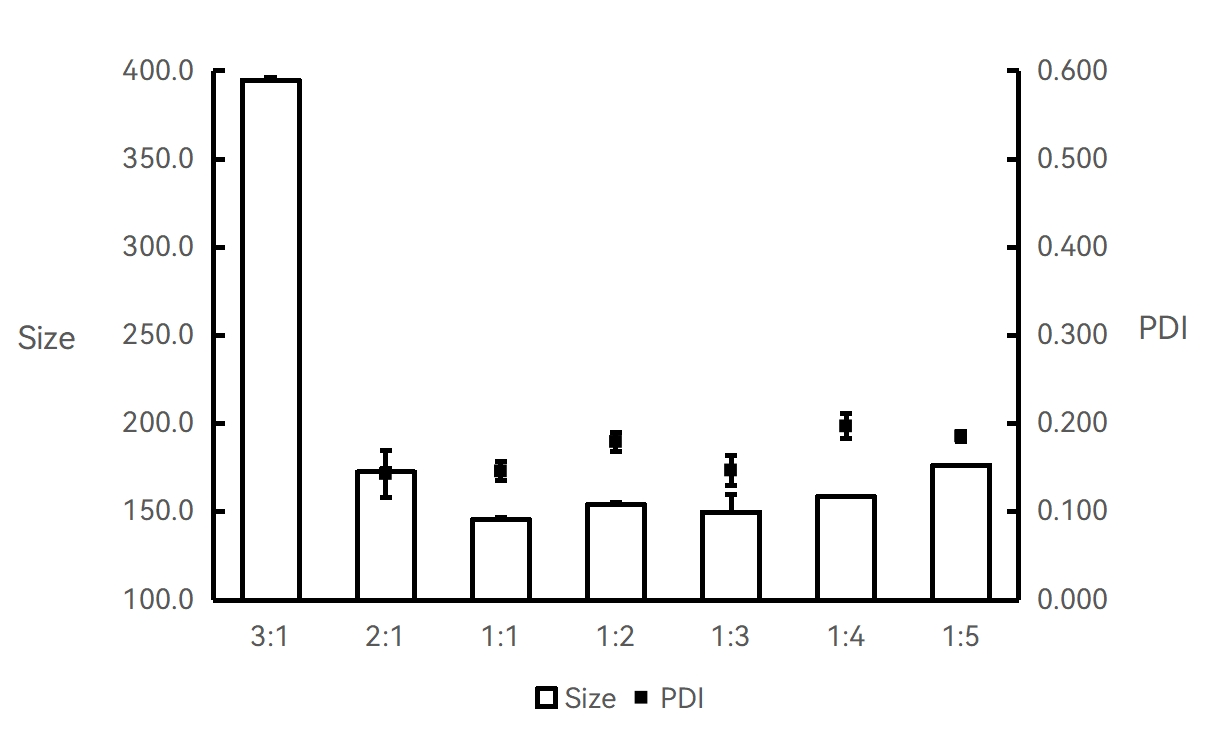
实验条件:仪器:Fluidiclab-NP-S2;芯片:Fluidiclab-MTGL-FL-001
20 mg/mL PLGA-丙酮溶液;总流速:8 mL/min;不同流速比;前废液:0.5 mL;产物使用超纯水稀释至10倍后检测。
【结论】该实验条件下,PLGA-丙酮与PVA水溶液使用1:1的流速比合成PLGA纳米颗粒粒径最小。
附件4:不同稀释方法与PLGA纳米颗粒粒径\PDI的关系
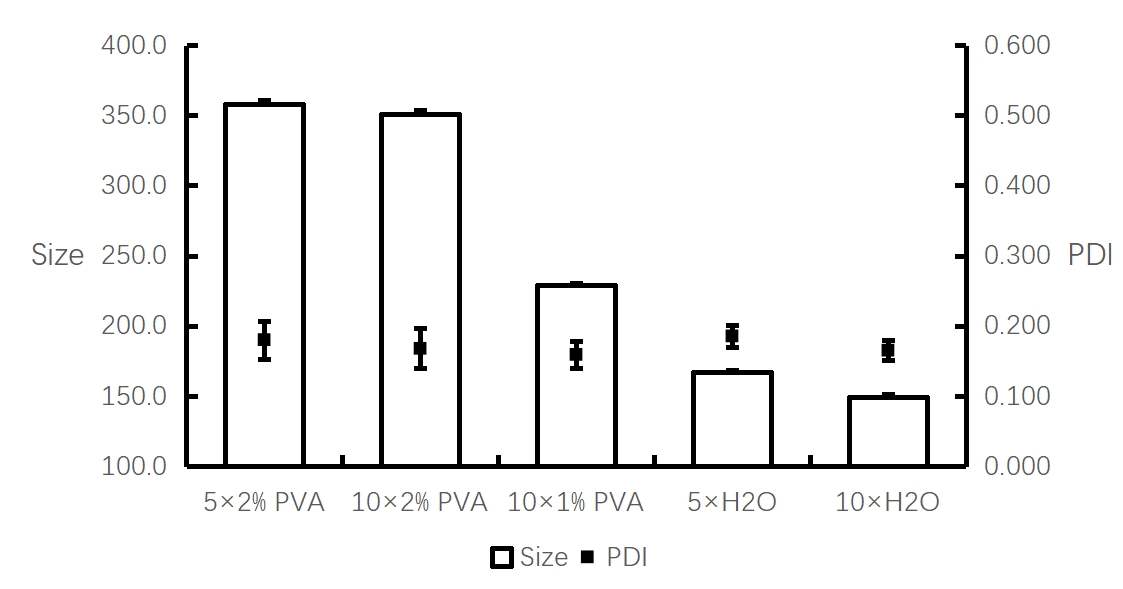
实验条件:仪器:Fluidiclab-NP-S2;芯片:Fluidiclab-MTGL-FL-001
20 mg/mL PLGA-丙酮溶液;总流速:8 mL/min;流速比1:1(脂相:水相);前废液:0.5 mL;产物使用超纯水或2%PVA溶液稀释。
【结论】
使用超纯水对合成的PLGA纳米颗粒初产物稀释10倍测得的粒径最小最均一。
由于PVA在水中会影响水对光的吸收及折射率,且水稀释纳米颗粒一般不会改变粒径,故认为水稀释后最能反应PLGA原始粒径,并推荐使用该稀释比检测。


























![图5. 基于微流控的冻融循环制备PVA微球[5]](https://cnfluidiclab.oss-cn-shanghai.aliyuncs.com/wp-content/uploads/2025/08/pic-5.png)