FluidicLab客户文献导读
成果简介:中国医药工业研究院国家先进医学工程研究中心的何军团队在《Nano Today》上发表了题为“Designed microchannel-based lipid nanoparticles encapsulated siRNA targeting gasdermin D for sepsis management via pulmonary delivery”的文章。GSDMD(Gasdermin D)属于Gasdermin蛋白家族,对其表达的抑制可以有效降低细胞膜穿孔从而抑制细胞焦亡。研究团队设计了一种新型连续微流控平台(CA/SAR/C1),通过优化微通道结构和流体动力学特性,高效制备封装siGSDMD(靶向Gasdermin D的小干扰RNA)的脂质纳米颗粒(LNPs)。siGSDMD-LNPs 在体外和体内研究中均表现出优异的递送和沉默功效,证明其通过抑制细胞焦亡,显著缓解脓毒症相关的炎症反应和器官损伤。
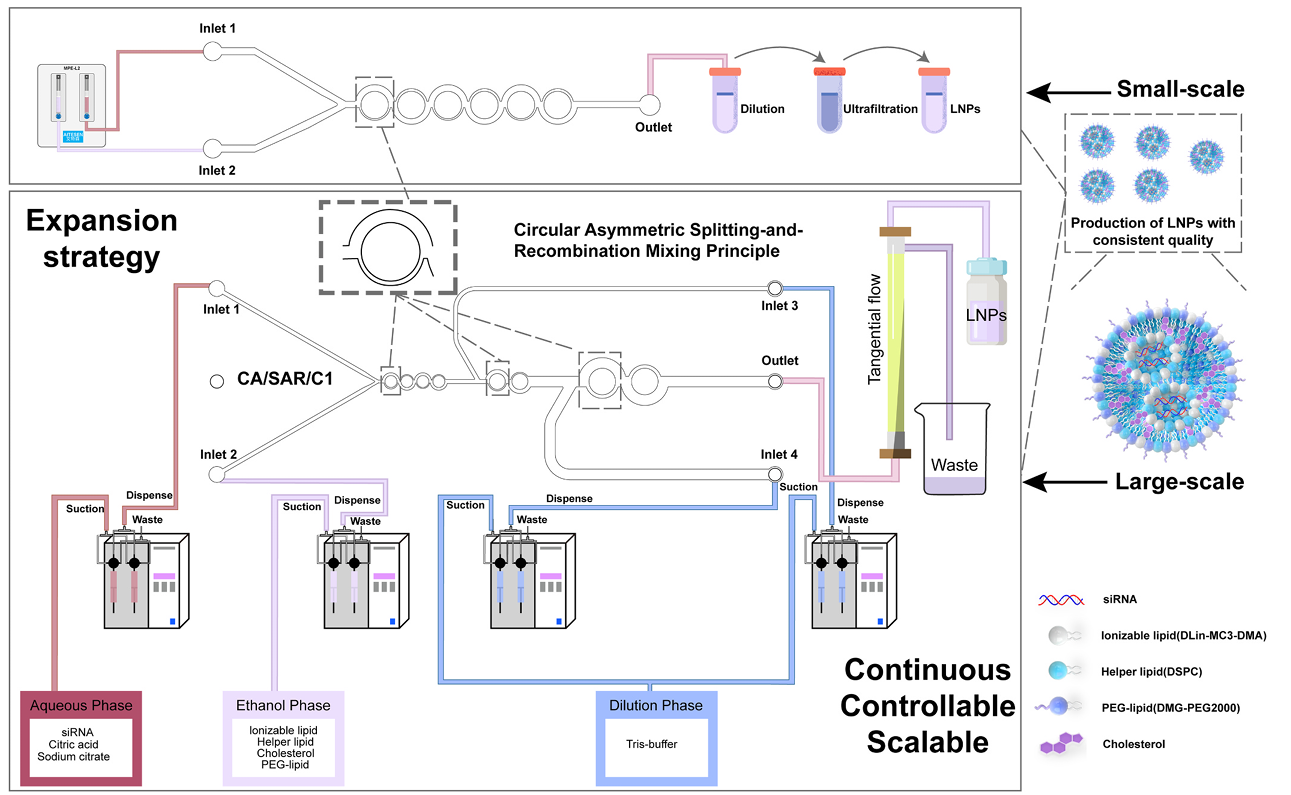
图1. CA/SAR微通道和CA/SAR/C1生产质量稳定的LNP的扩展策略
混合微流道设计、模拟。得到最优候选流道(Type C)
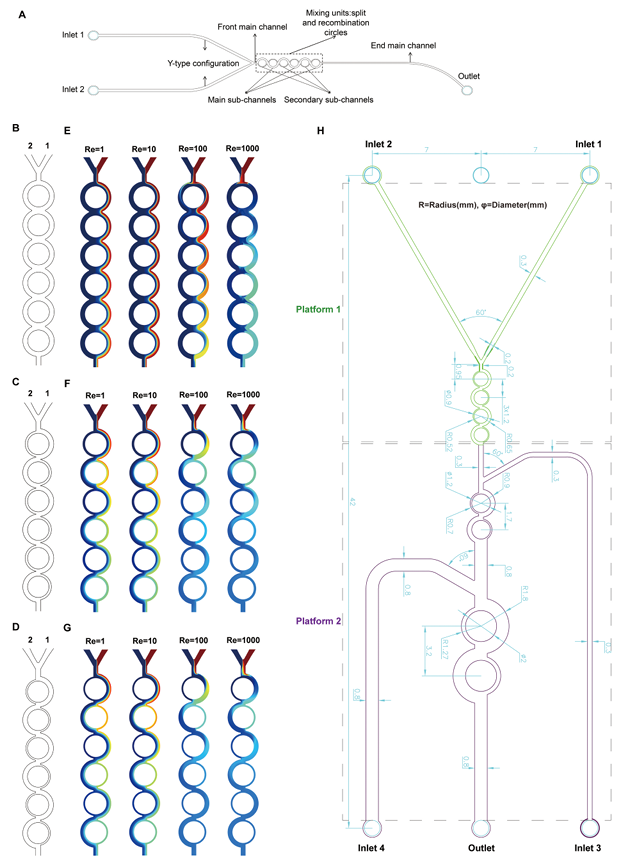
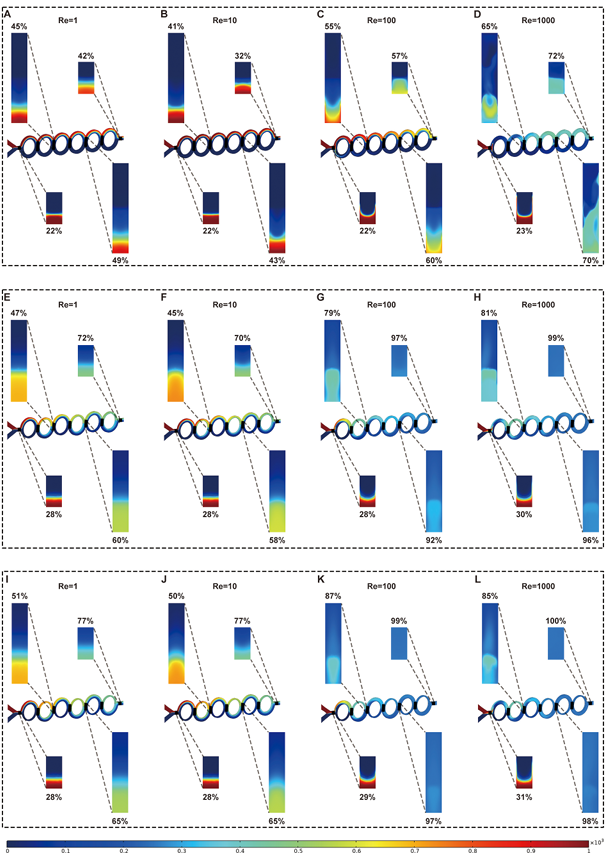
基于环形非对称分裂重组(Circular Asymmetric Split-and-Recombination, CA/SAR)原理,作者设计了三种候选微通道(Type A、B、C),其主次宽度比分别为1:1、2:1、3:1(图2)使用软件模拟流体行为,通过一系列的方程计算,并通过计算混合指数(MI)、压力降(ΔP)和混合效率成本(Mec)等关键参数,筛选出Type C为性能最优结构(图3)。通过CFD模拟评估混合效率,发现Type C(3:1)在雷诺数(Re)≥100时仅需3个循环即可实现90%以上的混合效率(Mixing Index, MI)(图4),为三者最优。
图 2.候选圆形 SAR 微通道图示及三个候选微通道在不同雷诺数 (Re) 下的单独混合行为
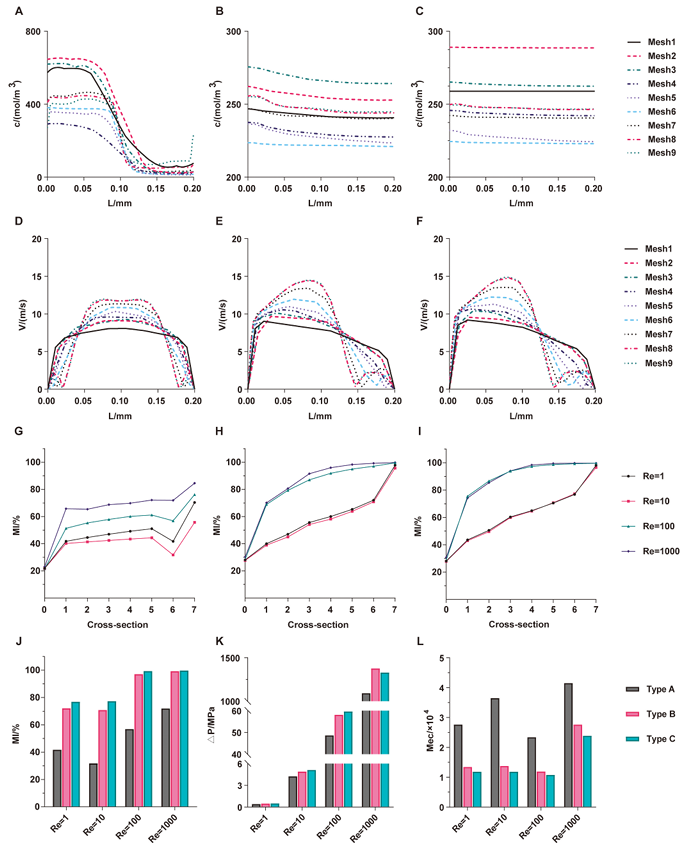 图 3. CFD模拟不同网格下的浓度和速度分布以及三种微通道的MI、△Pa 和 Mec
图 3. CFD模拟不同网格下的浓度和速度分布以及三种微通道的MI、△Pa 和 Mec
图4. Type A, B, C在截面0, 2, 4, 6(对应不同循环次数)和不同Re下的混合性能比较。
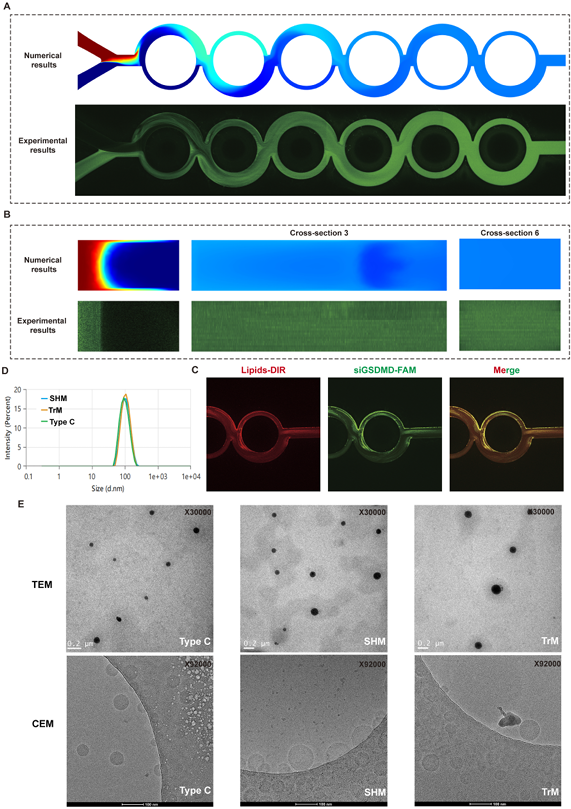
LNP制备实验中,Type C具有较好的混合效果
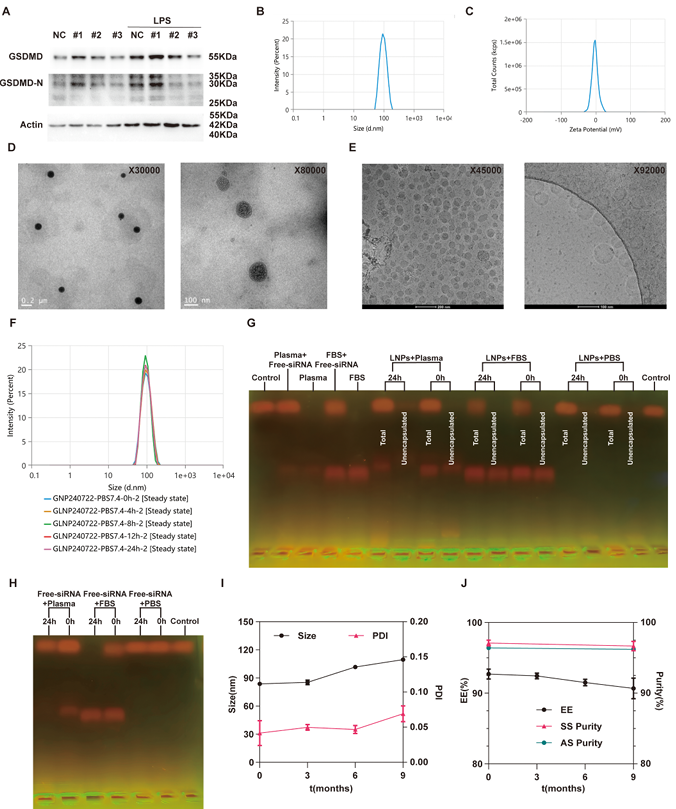
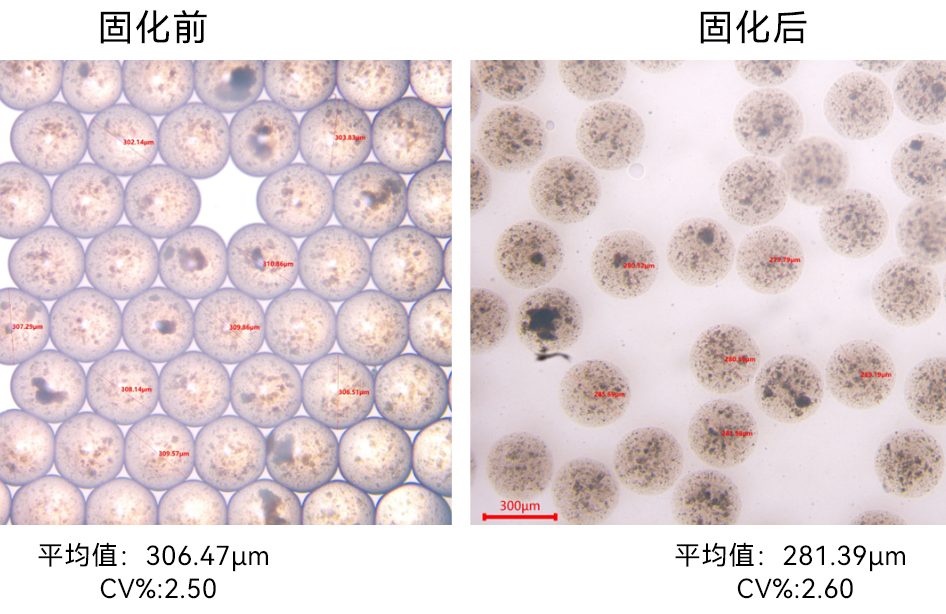
作者通过共聚焦激光扫描显微镜(CLSM)和动态光散射(DLS),验证Type C在LNPs制备时能实现均匀的混合,其制备的LNPs粒径较小(50nm以下)且分布均匀(多分散指数PDI<0.1)。形态观察到为致密的球形颗粒(图5)。该芯片LNP合成效果佳。该混合芯片由我司,上海澎赞生物有限公司制作。
图 5.C 型 (Re=660) 数值和实验之间的流体行为验证
制备得到的siGSDMD-LNPs具有优异的物理化学性质、稳定性和长期储存性能
作者通过WB筛选了有效的siRNA序列,并对于制备的siGSDMD-LNPs进行表征。在PBS (pH 7.4)、FBS或小鼠血浆中稀释时,siGSDMD-LNPs均表现出比游离siGSDMD显著更高的稳定性,表明LNPs有效地保护siGSDMD在FBS或血浆存在下不降解,具有相比游离siGSDMD更高的稳定性(图6)
图6. siGSDMD-LNPs的物理化学性质表征
siGSDMD-LNPs可被BMDMs摄取,并且siRNA可溶酶体逃逸
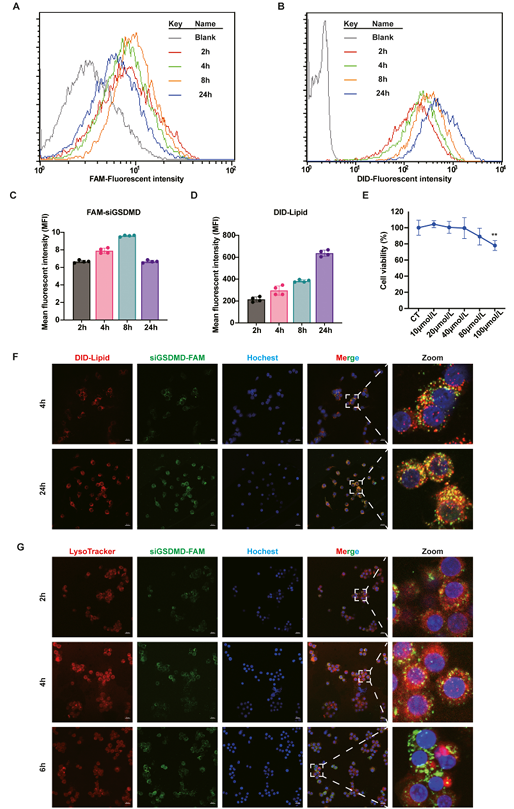
为了探究骨髓源性巨噬细胞(BMDMs)是否能摄取siGSDMD-LNPs,作者通过流式细胞术和CLSM检测了细胞活力以及siRNA的溶酶体逃逸能力。流式细胞检测显示 ,LNP (FAM 标记的 siGSDMD、DID 标记的脂质) 成功被 BMDM 内化 (图 7A-D)。siGSDMD-LNPs 对细胞活力没有显着影响(图 7E)。在 4 小时和 6 小时时,FAM 标记的 siGSDMD 逐渐分散在整个细胞质中(图 7G),表明其能够进行溶酶体逃逸,该LNP可以负载 siRNA 进行胞内递送。
图7. LNPs在细胞内摄取和递送效率的评估
siGSDMD-LNPs在体外具有抗炎作用
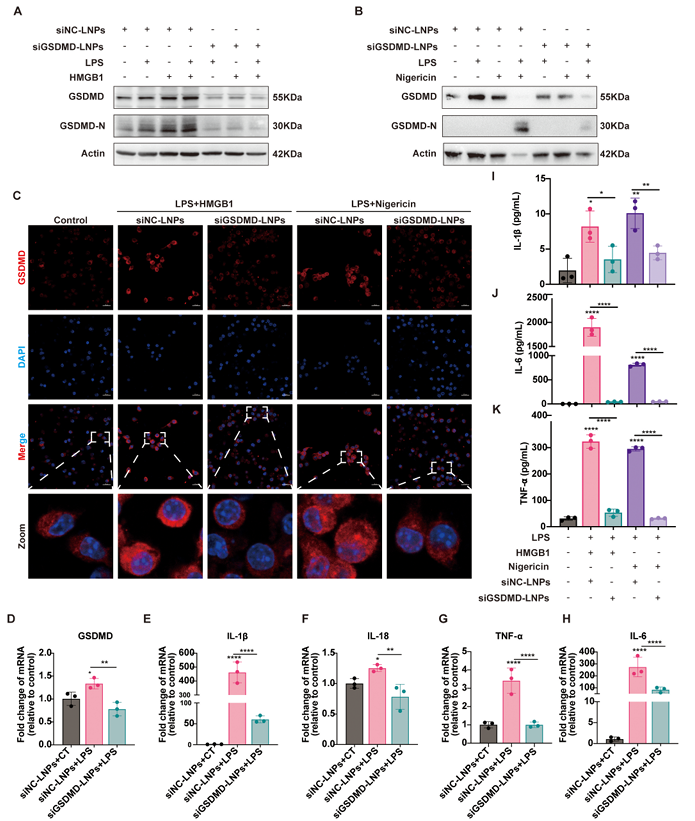
作者检测了siGSDMD-LNPs在体外对BMDMs中GSDMD表达和炎症因子释放的抑制作用。在mRNA水平,siGSDMD-LNPs显著下调LPS诱导脓毒症小鼠的GSDMD的表达。BMDMs中GSDMD的表达降低,显著降低了细胞因子IL-1β、IL-6和TNF-⍺的水平(图8I-K) 。该结果证明siGSDMD-LNPs通过抑制GSDMD介导的细胞焦亡,在脓毒性条件下对巨噬细胞发挥抗炎作用。
图8. LNPs在体外抗炎效果的评估
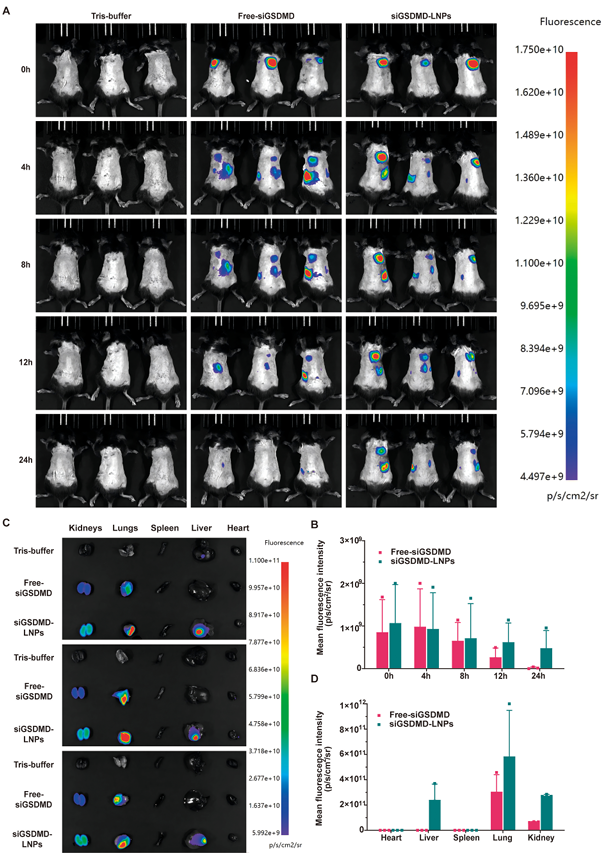
siGSDMD-LNPs肺部给药,在小鼠体内主要分布于肺部,且肺部积累,稳定时间长
肺部给药后,通过活体成像系统及离体器官检测了siGSDMD-LNPs在小鼠体内的组织分布,发现LNPs在肺部蓄积显著高于游离siRNA,表明肺内给药的有效性(图9)。
图9. LNPs在小鼠体内的组织分布
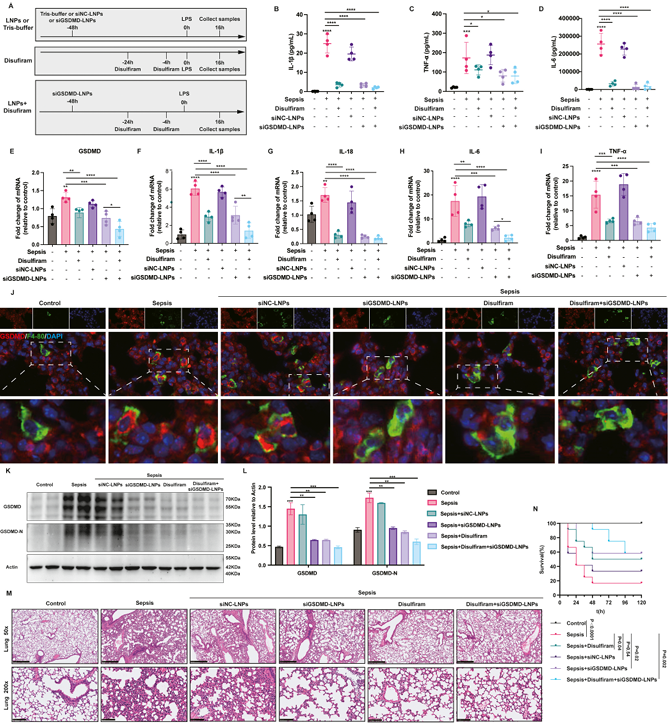
肺内给予siGSDMD-LNPs显著降低了脓毒症小鼠肺组织中GSDMD的表达量和炎症因子的表达,减轻了肺组织损伤,提高了生存率
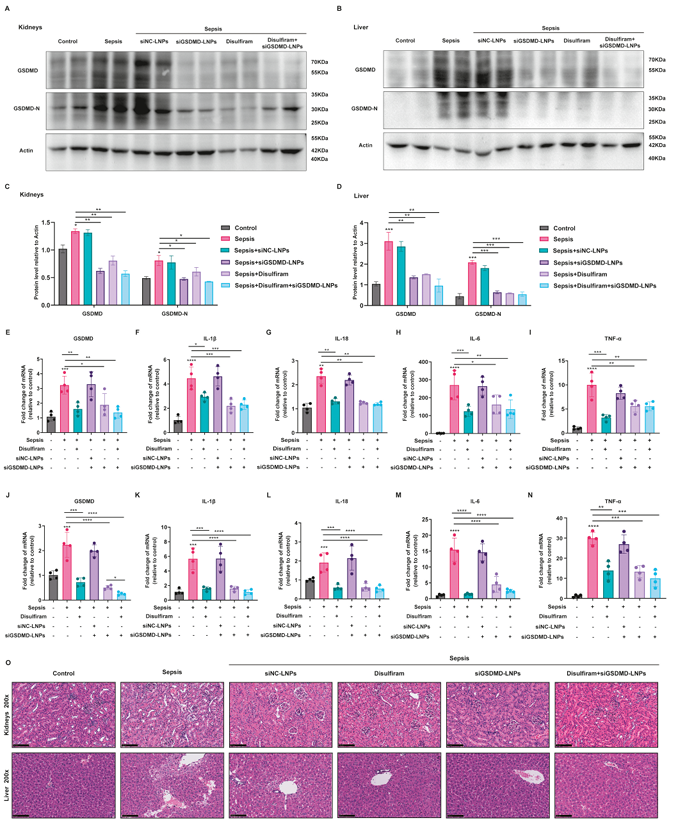
LPS诱导的败血症小鼠经肺部给药siGSDMD-LNPs后,肺中GSDMD蛋白和炎症因子表达显著降低(图10)。siGSDMD-LNPs也显著减轻了脓毒症小鼠肾脏和肝脏组织的损伤,降低了GSDMD和炎症因子的表达,且在多器官保护方面具有有效性(图11)。siGSDMD-LNPs对LPS诱导的脓毒症小鼠模型有显著的治疗效果。
图10. LNPs在体内治疗效果评估
图11. LNPs在多器官保护方面的评估
讨论与总结
综上所述,作者设计了一种基于微流控技术的连续制备平台,其核心优势在于非对称微通道设计和梯度稀释系统的结合,并用于制备高质量的siGSDMD-LNPs。 siGSDMD-LNPs具有良好的细胞摄取、溶酶体逃逸能力和组织分布特性,并通过沉默GSDMD有效抑制细胞焦亡,为脓毒症的治疗提供了新策略。