LNP递送系统在新冠疫苗中的出色表现使其受到越来越多的关注,而其配方成分不可避免地使LNP在体内更容易在肝脏中富集。选择合适的靶向策略是提高LNP对药物递送效率的关键。
来自CiMUS的Maria Jose Alonso教授于2023年3月在Journal of Controlled Release 上发表了题为《Targeted siRNA lipid nanoparticles for the treatment of KRAS-mutant tumors》的文章。他们筛选LNP配方、增加靶向多肽并对siRNA进行了不同的化学修饰,获得了有效靶向递送siRNA至肿瘤的LNP,并能够使肿瘤变小。
1.筛选高效的LNP配方
结论:LNP-S3递送siRNA具有更高的沉默效率以及最低的siRNA浓度需求
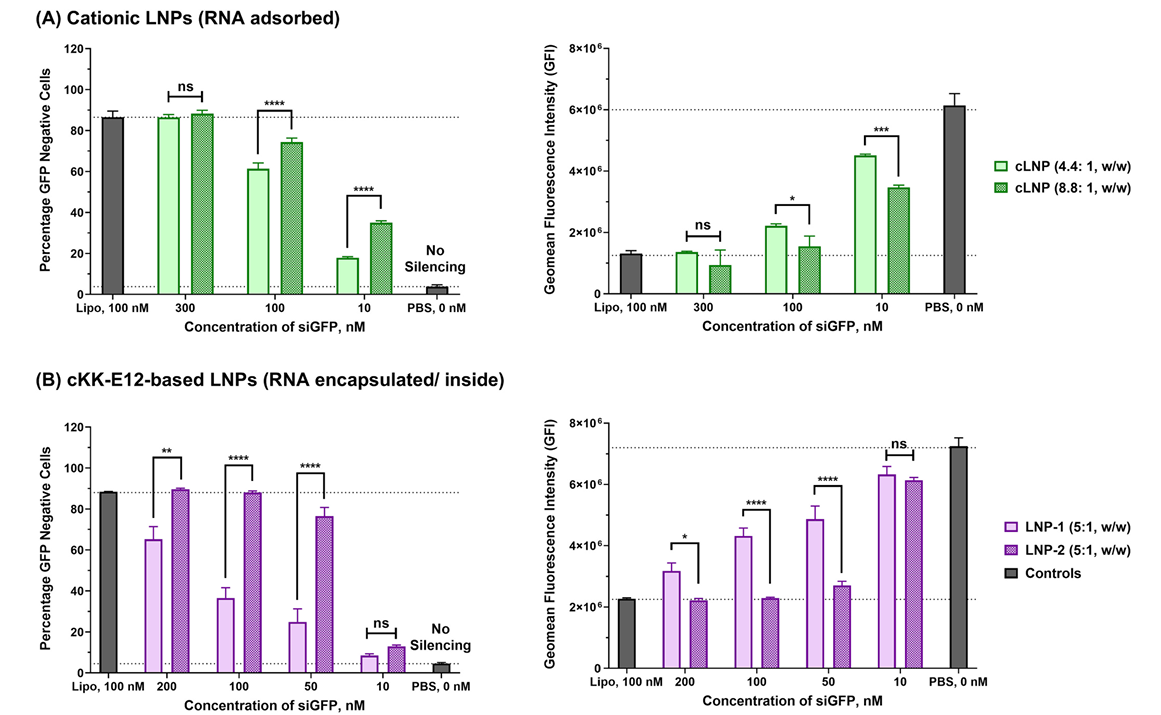
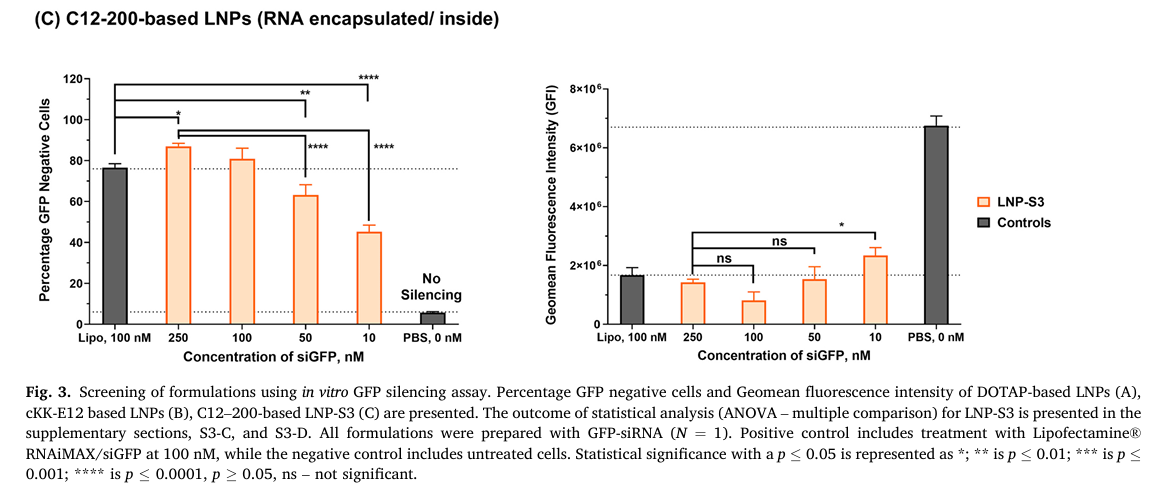
首先,作者对Hela-GFP细胞转染siGFP,通过沉默的效率来评估LNP的递送效率。对三种LNP配方(Table 2)(Cationic DOTAP LNPs, cKK-E12 LNPs, C12–200 LNPs)、不同氮磷比的Cationic DOTAP LNPs(Fig.3 A)以及组分比例不同的cKK-E12 LNPs(Fig.3 B)各自进行了测试。结果发现,Cationic DOTAP LNP中,拥有更高氮磷比的沉默效率更高;cKK-E12 LNP-B的配方比例沉默效率更高;基于C12-200合成的LNP中,LNP-S3的沉默效率(Fig.3 C左)相比Cationic LNP以及cKK-LNP,是三种LNP中最高的,且在10 nM的浓度下即可引发部分细胞中GFP表达的沉默(Fig.3 C右)。
2.验证LNP-S3在胞内的吸收能力
结论:LNP-S3被成功吸收至胞内。
作者于脂质组分中添加DiD染料并使用LNP-S3配方进行合成,转染Lacun3细胞。使用Hoechst(染细胞核)、Lysotracker Green(染溶酶体)对转染LNP的细胞染色并观察(Fig. 4)。Lysotracker Green与DiD重叠的部分显示为白色。于图中可见大量白色区域,溶酶体染色与属于LNP的DiD染色重合,即证明LNP-S3被成功吸收到了细胞内。
3.筛选能够高效敲除KRAS的siRNA
结论:siKRAS-ESC+的沉默效率优于siKRAS-LNA,没有修饰的siKRAS次之,siKRAS-Chol效率最差
ESC+,LNA,Chol修饰的含义见Fig2. B。
对siRNA进行化学修饰,可以提高其稳定性、增加沉默效率以及长期活性,同时可以降低脱靶效率。作者首先选择了一种可以沉默多种KRAS突变的siKRAS,并在此基础上对其进行了三种化学修饰(Table 1, Fig. 2)。
随后,使用LNP-S3包裹不同修饰的siKARS,(siTTR作为阴性对照),转染A549与CMT167细胞,敲除KARS,并使用Western blot检测KARS与其下游信号通路中磷酸化的ERK1/2(p44/p42),并以GAPDH为对照(Fig. S4,)。结果发现:siKARS-ESC与siKARS-LNA的敲除效果更好,被选择进行后续体内实验。另外,虽然作下图为阴性对照,但siTTR对人源细胞A549中的KARS也产生了一定的敲除效果,作者认为这是由于引导链介导的类似于miRNA种子片段的碱基配对造成的。
4.靶向LNP-S3-tLyp-1包裹siKARS-LNA的效果验证
结论:筛选得到的LNP配方与siRNA的组合能够在体外实现KARS基因的敲除
为了能够靶向至CFPAC-1胰腺癌细胞,选择了截短的Lyp-1多肽(tLyp-1)。tLyp-1能够与CFPAC-1细胞表面的NRP受体结合,通过in-situ的方式,将tLyp-1共价连接到合成的LNP-S3上,使得LNP-S3具有CFPAC-1的靶向性。另外,由于LNP-S3配方中Tween80的存在,tLyp-1能够显著减少与配方中另一组分DOPE聚合。
将装载了siKARS-ESC+的传统配方LNP2与LNP-S3-tLyp1转染CFPAC-1细胞,并与吉西他滨共同处理该细胞(Fig. 5)。通过Western blot检测ERK/pERK、qPCR检测KRAS的表达水平以及与吉西他滨共作用后细胞的存活率可知,包裹siKRAS-LNA的LNP-S3-tLyp-1对KRAS具有更好的敲除效果。
5.LNP-S3-tLyp-1在体内的生物分布
结论:携带tLyp-1的LNP能够实现对目标肿瘤细胞的靶向
将包裹了siKARS-LNA的带有DiR染料的LNP-S3-tLyp-1与LNP-S3静脉注射入移植了CFPAC-1细胞的肿瘤小鼠模型体内。32小时后,通过荧光强度与单位荧光强度可知(Fig. 6),LNP-S3-tLyp-1除了在肝脏中不可避免地堆积外,在脾、肺以及肿瘤中都显著性地堆积。而LNP-S3则没有肺部,特别是肿瘤部位的靶向。通过IVIS可以显著观察到上述结果(Fig. 6 C)。因此使用tLyp-1分子对CFPAC-1靶向效果十分显著。
6.LNP-S3-tLyp-1与吉西他滨共同给药对肿瘤的协同效果
结论:LNP-S3-tLyp-1通过沉默KARS基因及其下游信号通路中的ERK基因,提高吉西他滨对肿瘤的治疗效果
同样以CFPAC-1细胞肿瘤小鼠为模型,LNP-S3-tLyp-1包裹siKARS-ESC,进行为期十天的吉西他滨与LNP共同给药治疗。结果显示,吉西他滨在LNP-S3-tLyp-1的帮助下,肿瘤显著减小。且KARS基因与ERK基因的表达都显著下降。
然而,随着肿瘤的减小,小鼠的生存率并没有随之增加。与之相反的是,未接受药物处理的小鼠生存率较高。这可能与吉西他滨的毒性有关。作者认为LNP的加入并没有进一步增加吉西他滨的毒性,反而提高了一部分存活率。肿瘤缩小证明协同用药是可行且有效的,但吉西他滨的用药量仍需进一步研究。
总的来说,在这篇文章的工作中,作者对LNP的配方以及siRNA的修饰进行了优化与筛选,讨论了靶向分子的连接方式,并最终实现了LNP对肿瘤的高效靶向给药。与吉西他滨的联用可以使得肿瘤进一步缩小。虽然在用药量方面仍需优化,但这一靶向治疗的成功说明了LNP作为siRNA的递送载体,在未来的肿瘤治疗中有着巨大的潜力。




































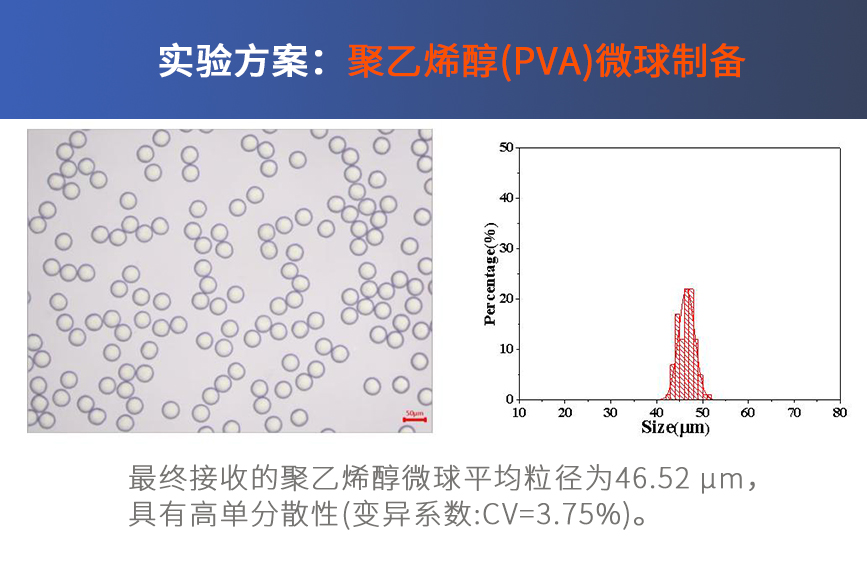
![图5. 基于微流控的冻融循环制备PVA微球[5]](https://cnfluidiclab.oss-cn-shanghai.aliyuncs.com/wp-content/uploads/2025/08/pic-5.png)